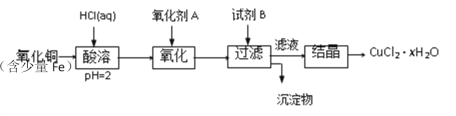
题目内容
【题目】铁在史前就为人们所知,由于铁、钴、镍性质很相似故称为铁系元素。回答下列问题:
(1)铁、钴、镍中未成对电子数目最多的为_____,镍的外围电子轨道表达式为_____。
(2)Co2+可以和SCN-作用形成蓝色配离子,该反应可用于Co2+的定性检验。
①SCN-的空间构型为____,组成元素中第一电离能最大的是___。
②SCN-对应的酸有硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中后者沸点较高,主要原因是_________________。
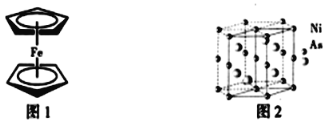
(3)二茂铁是一种夹心式结构的配合物,通常认为是由一个Fe2+离子和两个C5H5-离子形成的,X射线研究结果指出两个C5H5-环的平面是平行的,结构如图1所示。C5H5-中碳原子的杂化类型为_____。分子中的大π键盘可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
(4)NiAs晶体中的原子堆积方式如图2所示,其中As的配位数为______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,NiAs的密度为______g·cm-3,(列出计算式)。
【答案】铁 ![]() 直线型 N 异硫氰酸分子之间可以形成氢键 sp2
直线型 N 异硫氰酸分子之间可以形成氢键 sp2 ![]() 6
6 ![]() 或
或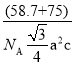
【解析】
(1)未成对电子数目根据基态原子电子排布式进行判断;
(2)①SCN-的空间构型根据等电子体进行判断;同一周期,随原子序数的增加,元素第一电离能呈现增大的趋势,同一主族,最电子层数的增加,元素的第一电离能逐渐减小;
②H-N=C=S分子中存在强极性键N-H,致其分子间易形成氢键,故H-N=C=S沸点比H-S-C≡N高;
(3)由题意可知C5H5-的C环是平面的,故知其中5个C原子应为sp2杂化;因5个C原子均为sp2杂化,则应各有一个未杂化的p电子参与形成5个C原子的大![]() 键,加上负电荷的电子,共有6个电子参与形成大
键,加上负电荷的电子,共有6个电子参与形成大![]() 键;
键;
(4)此为六方晶胞,单晶胞体积为![]() ;整个六方晶胞体积为
;整个六方晶胞体积为![]() ,整个六方晶胞中Ni原子数为12
,整个六方晶胞中Ni原子数为12![]() +6
+6![]() +2
+2![]() +1=6,As原子数为6,根据
+1=6,As原子数为6,根据![]() 计算。
计算。
(1)根据基态原子电子排布式Fe为1s22s22p63s23p63d64s2、Co为1s22s22p63s23p63d74s2、Ni为1s22s22p6 3s23p63d84s2可知,未成对电子数目最多的是铁,镍的外围电子轨道表达式为![]() ;
;
(2)①SCN-的等电子体是CO2,空间构型相同为直线型;同一周期,随原子序数的增加,元素第一电离能呈现增大的趋势,同一主族,最电子层数的增加,元素的第一电离能逐渐减小,故组成元素中第一电离能最大的是N;
②H-N=C=S分子中存在强极性键N-H,致其分子间易形成氢键,故H-N=C=S沸点比H-S-C≡N高;
(3)由题意可知C5H5-的C环是平面的,故知其中5个C原子应为sp2杂化;因5个C原子均为sp2杂化,则应各有一个未杂化的p电子参与形成5个C原子的大![]() 键,加上负电荷的电子,共有6个电子参与形成大
键,加上负电荷的电子,共有6个电子参与形成大![]() 键,故大Π键为
键,故大Π键为![]() ;
;
(4)此为六方晶胞,单晶胞体积为![]() ;整个六方晶胞体积为
;整个六方晶胞体积为![]() ,整个六方晶胞中Ni原子数为12
,整个六方晶胞中Ni原子数为12![]() +6
+6![]() +2
+2![]() +1=6,As原子数为6,故:
+1=6,As原子数为6,故:![]() g/cm3或
g/cm3或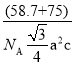 。
。

【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)