题目内容
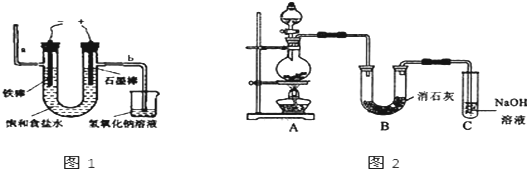
6.下列反应的离子方程式书写正确的是( )| A. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 碳酸钙与稀醋酸反应:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑ | |
| C. | 铁粉与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 铜片与氯化铁溶液反应 Cu+Fe3+=Cu2++Fe2+ |
分析 A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
B.碳酸钙和醋酸都需要保留化学式;
C.铁与稀盐酸反应生成氯化亚铁和氢气;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B.碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.铁与稀盐酸反应生成氯化亚铁,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;
D.铜与铁离子反应生成亚铁离子和铜离子,正确的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
14.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量大于生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
15.将一定体积密度为1.3g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.己知反应后所得溶液的质量等于原BaCl2溶液的质量,则原硫酸溶液浓度为( )
| A. | 33.9% | B. | 31.0% | C. | 6.65 mol/L | D. | 5.58 mol/L |
16.苹果被誉为全方位的健康水果,其味道酸甜可口,营养丰富.下列有关苹果化学小实验及其结论不合理的是
( )
( )
| A. | 未成熟的苹果肉遇碘酒变蓝色,说明其中含淀粉 | |
| B. | 苹果可以制作水果电池,说明苹果汁含有电解质 | |
| C. | 成熟的苹果汁能与新制Cu(OH)2反应生成砖红色沉淀,说明其中含葡萄糖 | |
| D. | 在苹果存放处,放置KMnO4溶液,可使苹果尽快成熟 |
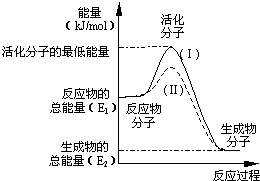 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题: