题目内容
17.氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气.Ⅰ.工业上通常采用电解法制氯气:观察图1,回答:
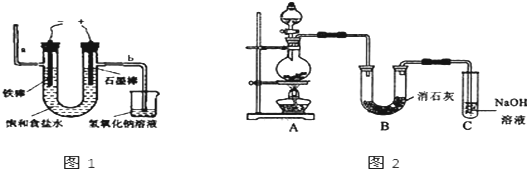
(1)电解反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2.
Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)漂白粉将在U形管中产生,其化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(3)C装置的作用是吸收未反应完的氯气,防止污染空气.
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是冷却B装置.
②试判断另一个副反应(用化学方程式表示)2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置做何改进在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶.
分析 I.(1)电解饱和食盐水生成氢氧化钠、氢气和氯气;
(2)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝;
Ⅱ.(1)实验室用浓盐酸与二氧化锰在加热条件下制备氯气;
(2)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水;
(3)氯气有毒,不能直接排放到空气中,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收过量的氯气;
(4)①依据信息可知温度较高时氯气与消石灰反应生成Ca(ClO3)2,为为避免此副反应的发生应降低温度;
②挥发出的氯化氢能够与氢氧化钙发生酸碱中和反应;要避免此反应的发生应该除去氯气中的氯化氢.
解答 解:I. (1)电解饱和食盐水生成氢氧化钠、氢气和氯气,化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝,所以检验氯气的方法为:移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2;
故答案为:移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2;
Ⅱ.(1)浓盐酸与二氧化锰在加热条件下生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)氯气有毒,不能直接排放到空气中,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收过量的氯气;
故答案为:吸收未反应完的氯气,防止污染空气;
(4)①依据信息可知温度较高时氯气与消石灰反应生成Ca(ClO3)2,为为避免此副反应的发生应该冷却B装置;
故答案为:冷却B装置;
②挥发出的氯化氢能够与氢氧化钙发生酸碱中和反应,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;要避免此反应的发生应该除去氯气中的氯化氢,可以在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶,
故答案为:2HCl+Ca(OH)2=CaCl2+2H2O;在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶.
点评 本题考查了氯气的工业、实验室制法和氯气的性质,解题关键在于明确实验室制备氯气的原理和氯气的性质,题目难度不大.

| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(一)制备1-溴丁烷粗产品:在下图装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O

(1)图1反应装置中加入沸石的目的是防止暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.
(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
| A. | 标准状况下6.72L NH3的质量约为5.1g | |
| B. | 10g D216O分子中所含中子数为4NA | |
| C. | 2.3g金属钠全部变成钠离子失去的电子数目为0.2NA | |
| D. | 150mL1mol/L氯化钠溶液与50mL1mol/L AlCl3溶液中氯离子的物质的量浓度相等 |
| A. | NaCl水溶液 | B. | 盐酸 | C. | 铝 | D. | KOH固体 |
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=___kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=___kJ.mol-1( )
| A. | 99、-41 | B. | +99、+41 | C. | -99、+41 | D. | -99、41 |
| A. | NaHSO4=Na++H++SO42- | B. | Ba(OH)2=Ba2++2OH- | ||
| C. | CaCO3=Ca2++CO32- | D. | KHCO3=K++H++CO32- |
| A. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 碳酸钙与稀醋酸反应:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑ | |
| C. | 铁粉与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 铜片与氯化铁溶液反应 Cu+Fe3+=Cu2++Fe2+ |
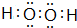 ;YW2分子形状为直线形.
;YW2分子形状为直线形.