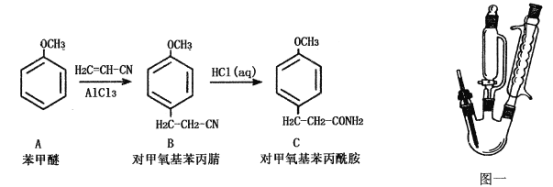
��Ŀ����
����Ŀ����Ҫ����գ�
��1���Խ���̼������ˮ��Һ�Լ��Ե�ԭ��_____________________________���������ӷ���ʽ�������������ͣ�
��2��CuSO4��ˮ��Һ�����Ե�ԭ���ǣ�________�������ӷ���ʽ��ʾ����ʵ����������CuSO4��Һʱ������CuSO4����Һ�м����������ᣬ��Ŀ����________��
��3����25��ʱ����Ũ�Ⱦ�Ϊ0.1mol/L��������Һ�У��٣�NH4��2SO4�ڣ�NH4��2CO3�ۣ�NH4��2Fe(SO4)2�ܰ�ˮ������NH4+�����ʵ���Ũ����С�����˳����________������ţ���
��4����0.1mol��L-1NaOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol��L-1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�

�ٵζ������������___________���I������
�ڵζ���ʼǰ��0.1mol��L-1NaOH��0.1mol��L-1�������0.1mol��L-1����������Һ����ˮ�������c(H+)������_______��Һ��
��ͼI�У�V=10ʱ����Һ�е�c(H+)_________c(OH-)���>������������<������ͬ����c(Na+)_________c(CH3COO-)��
��5��������������Һ��a��pH=4NH4Cl,b��pH=4������Һ������ˮ�����c��H+��֮��Ϊ______��
��6����֪:25��ʱKSP[Cu(OH)2]=2��10-20�������£�ijCuSO4��Һ��c��Cu2+��=0.02molL-1����Ҫ����Cu(OH)2������Ӧ������Һ��pH��СΪ________��
���𰸡���Һ���ڵ���ƽ�⣺HCO3-H++CO32-��ͬʱ����ˮ��ƽ�⣺HCO3-+H2OH2CO3+OH-��ˮ��̶ȴ��ڵ���̶� Cu2++2H2OCu(OH)2+2H+ ����ͭ���ӵ�ˮ�� ��>��>��>�� I ���� > < 106 5
��������
(4)���ڴ�������Һ�д��ڴ������ˮ�⣬������Һ�Լ��ԣ���NaOH��Һ�ζ�����ʱ�ζ��յ��Լ��ԣ�����IΪ�ζ���������ߣ�IIΪ�ζ���������ߡ�
(1)̼��������Һ�д���̼������ĵ���ƽ�⣺HCO3-H++CO32-������ˮ��ƽ�⣺HCO3-+H2OH2CO3+OH-������ˮ��̶ȴ��ڵ���̶ȣ�����̼��������Һ�Լ��ԣ�
(2)Cu����ˮ��ʹ����ͭˮ��Һ�����ԣ�ˮ�ⷽ��ʽΪ��Cu2++2H2OCu(OH)2+2H+��������CuSO4��Һʱ����CuSO4����Һ�м������������������ͭ���ӵ�ˮ�⣻
(3)4����ҺŨ����ȣ�(NH4)2SO4��(NH4)2CO3��(NH4)2Fe(SO4)2��Ϊǿ����ʿ��Ե������笠�����һˮ�ϰ�Ϊ�������ˮ��笠�����Ũ����С��̼�����ˮ����Դٽ�笠���ˮ�⣬Fe2+��ˮ���������笠���ˮ�⣬������Ȳ��ٽ�Ҳ�����ƣ�����NH4+�����ʵ���Ũ����С�����˳���ǣ���>��>��>�ܣ�
(4)�����ڴ�������Һ�д��ڴ������ˮ�⣬������Һ�Լ��ԣ���NaOH��Һ�ζ�����ʱ�ζ��յ��Լ��ԣ�����IΪ�ζ���������ߣ�
������ĵ����������ˮ�ĵ��룬���������������ӻ�������Ũ��Խ���ˮ����������Խǿ��HClΪǿ�ᣬNaOHΪǿ�����ͬŨ�ȵĶ��߶�ˮ�ĵ�������Ƴ̶���ͬ��������Ϊ���ᣬ��ͬŨ��ʱ�������������Ũ�Ƚ�С����ˮ�ĵ�������Ƴ̶Ƚ���������������Һ����ˮ�������c(H+)�����Ǵ�����Һ��
�۾�ͼ��֪V=10ʱ��Һ�����ԣ�����c(H+)>c(OH-)����Һ�д��ڵ���غ㣺c(H+)+ c(Na+)= c(OH-)+c(CH3COO-)����c(H+)>c(OH-)������c(Na+)< c(CH3COO-)��
(5)�κ���Һ��ˮ�������������Ũ�Ⱥ�������Ũ�Ⱦ���ȣ������£�pH=4��NH4Cl��Һ��c(H+)=10-4mol/L����ȫ����ˮ���룻pH=4��������Һ��c(OH-)=10-10mol/L����ȫ����ˮ���룬���Զ���ˮ�����c(H+)֮��Ϊ![]() ��
��
(6)Ksp [Cu(OH)2]= c(Cu2+)��c2(OH-)=2��10-20�����Ե�c(Cu2+)=0.02molL-1ʱ��c(OH-)=![]() =1��10-9mol/L���¶�Ϊ25��������Һ��c(H+)=1��10-5mol/L��pH=5��
=1��10-9mol/L���¶�Ϊ25��������Һ��c(H+)=1��10-5mol/L��pH=5��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����25��ʱ����AgCl�İ�ɫ����Һ�У����μ����Ũ�ȵ�KI��Һ��Na2S��Һ���۲쵽���������ȳ��ֻ�ɫ���������ճ��ֺ�ɫ��������֪�й����ʵ��ܶȻ�Ksp(25��)�����ʾ��
AgCl | AgI | Ag2S | |
Ksp | 1.8��1010 | 8.3��1017 | 6.3��1050 |
���������������
A.����ת����ʵ�ʾ��dz����ܽ�ƽ����ƶ�
B.�ܽ��С�ij�������ת��Ϊ�ܽ�ȸ�С�ij���
C.AgCl����ֱ��ڵ�Ũ�ȵ��Ȼ��غ��Ȼ�����Һ�е��ܽ������ͬ��
D.25��ʱ���ڱ���AgCl��AgI��Ag2S��Һ�У�����Ag+��Ũ�Ȳ�ͬ