题目内容
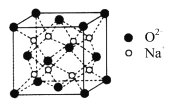
【题目】下列物质结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表除形成共价键外的其他最外层电子,短线代表共价键,如F2:![]() 。
。
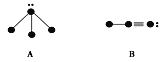

⑴试写出四种图示所代表的化学式:
A___________,B___________,C___________,D___________。
⑵将上述四种物质的液体呈细流流下,用带静电的玻璃棒靠近细流,细流发生偏转的是_____________(填“A”“B”“C”“D”)。
⑶B分子中有__________个δ键,___________个π键。
⑷C分子中,中心原子杂化类型____________其分子空间构型是_______________。
【答案】 NH3 HCN BF3 CO(NH2)2 ABD 2 2 sp2 平面三角形
【解析】(1)根据示意图可判断A是氨气,B是HCN,C是BF3,D是尿素,化学式为CO(NH2)2;(2)四种物质中只有C是非极性分子,因此将上述四种物质的液体呈细流流下,用带静电的玻璃棒靠近细流,细流发生偏转的是ABD。(3)B分子中含有1个单键和1个三键,则有2个δ键,2个π键。(4)C分子中,中心原子的价层电子对数是3,没有对孤对电子,采取sp2杂化,其分子空间构型是平面三角形。

【题目】(Ⅰ)氮及其化合物在工农业生产中具有广泛的用途,农业对化肥的需求是合成氨工业发展的持久推动力。某小组进行工业合成氨N2(g)+3H2(g)![]() 2NH3(g) △H<0的模拟研究,在2L密闭容器中,保持体系内温度600℃不变,分别加入0.2mol N2和0.6mol H2。实验a、b、c中c(N2)随时间(t)的变化如下图所示。
2NH3(g) △H<0的模拟研究,在2L密闭容器中,保持体系内温度600℃不变,分别加入0.2mol N2和0.6mol H2。实验a、b、c中c(N2)随时间(t)的变化如下图所示。
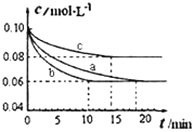
(1)实验b从开始到达平衡状态的过程中,用H2表示的平均反应速率为______________,600℃时,该反应的化学平衡常数为____________(计算结果保留一位小数)。
(2)与实验a相比,实验b所采用的实验条件可能为________________(填字母序号,下同),实验c所采用的实验条件可能为_________________。
A.增大压强 B.减小压强 C.升高温度 D.使用催化剂
(3)下列条件能使该反应的反应速率增大,且能提高H2的转化率的是___________
A.及时分离出氨气 B.适当增大压 C.增大H2的浓度 D.选择高效催化剂
(4)恒温恒容条件下,表明该反应达到化学平衡状态的标志是___________
A. 混合气体的压强不再改变的状态
B. 混合气体的密度不再改变的状态
C. 混合气体的平均相对分子质量不再改变的状态
(Ⅱ)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)CH3OH(g) △H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①根据表中数据可判断△H___________0 (填“>”、“=”或“<”).
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反
应将 _____________(填字母序号).
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1451.6kJmol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______________________ 。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,则负极的电极反应式为___________________,随着反应的不断进行溶液的pH _____________(填“增大”“减小”或“不变”).
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为____________________________;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 _______ mL(标况下),此时电路中通过的电子数为_________________________。