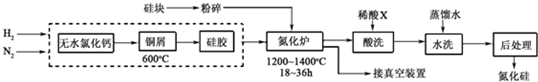
题目内容
17.用下列物质冶炼相应金属时采用电解法的是( )| A. | Fe2O3 | B. | Ag2O | C. | Cu2S | D. | Al2O3 |
分析 电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的Al2O3)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:冶炼不活泼的金属Hg、Ag用加热分解氧化物的方法制得.
解答 解:A.Fe用热还原法冶炼,故A不选;
B.Ag用加热分解氧化物的方法即热分解法冶炼,故B不选;
C.Cu用热还原法冶炼,故C不选;
D.Al的性质很活泼,用电解其氧化物的方法冶炼,故D选.
故选D.
点评 本题考查金属冶炼的一般方法和原理,根据金属的活泼性采用相应的冶炼方法,难度不大.

练习册系列答案
相关题目
7.下列关于化学反应速率的说法错误的是( )
| A. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
5.向一定量的Cu、Fe2O3的混合物中加入100mL 2mol•L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A. | 3.2g | B. | 2.4g | C. | 1.6g | D. | 0.8g |
12.将9g铜和铁的混合物投入到100mL稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12L NO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是( )
| A. | 原混合物中铜和铁各0.075mol | |
| B. | 稀硝酸的物质的量浓度为2.0mol•L-1 | |
| C. | 第一次剩余4.8g金属为铜和铁 | |
| D. | 向反应后的溶液中再加入该稀硝酸100mL,又得到NO在标准状况下体积小于1.12L |
2.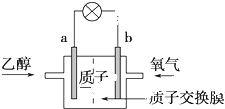 一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
 一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子做溶剂,比甲醇电池效率高出32倍.电池示意图如图 所示:电池总反应为C2H5OH+3O2═2CO2+3H2O.下列对该电池的说法正确的是( )| A. | b极为电池的负极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 当1 mol乙醇被氧化转移12NA个电子 | |
| D. | 电池负极的电极反应为4H++O2+4e-═2H2O |
9.常温下,0.1mol•L-1的三种盐溶液NaX、NaY、NaZ的pH分别为 7、8、9,则下列判断中正确的是( )
| A. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)>K(HY) | D. | HX、HY、HZ的酸性依次增强 |
6.2010年上海世博会中国馆--“东方之冠”的主体结构为四根巨型钢筋混凝土制成的核心筒.其中钢属于( )
| A. | 合金 | B. | 复合材料 | C. | 纯净物 | D. | 有机材料 |
 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.