题目内容
8.写出下列反应的离子方程式(1)向澄清石灰水中加盐酸OH-+H+=H2O
(2)用石灰石与盐酸反应制取二氧化碳CaCO3+2H+=Ca2++CO2↑+H2O
(3)锌粉加入硫酸溶液中Zn+2H+=Zn2++H2↑.
分析 (1)澄清石灰水与盐酸反应生成氯化钙和水;
(2)碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水,碳酸钙需要保留化学式;
(3)锌与稀硫酸反应生成硫酸锌和氢气.
解答 解:(1)澄清石灰水为Ca(OH)2溶液,盐酸为一元强酸,反应的实质为:OH-+H+=H2O,
故答案为:OH-+H+=H2O;
(2)石灰石的主要成分是CaCO3,难溶于水,与盐酸反应生成二氧化碳气体,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)锌为活泼金属,锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,如:难溶物、弱电解质等需要保留化学式,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.将混有碳酸钠杂质的碳酸氢钠样品42.0g,加热至质量不再变化时,称得固体质量为29.6g.则样品中碳酸钠的质量百分含量为( )
| A. | 70.5% | B. | 20% | C. | 29.5% | D. | 80% |
19.为了减少大气中二氧化碳的含量,下列措施不可行的是( )
| A. | 改进能源结构 | B. | 提高能源利用率 | ||
| C. | 大量使用化石燃料 | D. | 提倡植树种草 |
16.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 2mol•L-1 NaCl溶液 | B. | 50mL 2mol•L-1CaCl2溶液 | ||
| C. | 100mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
20.某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组综合热测定的实验,实验试剂及其用量如表所示:
(1)实验①中碱液过量的目的是使盐酸充分反应,提高实验的准确度.
(2)甲同学预计△H1≠△H2,其依据是NH3•H2O是弱电解质,存在电离平衡,电离过程是吸热程.
(3)上表中终了温度为反应过程中混合溶液的最高温度(填“最高温度”或“平均温度”).
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热△H偏大(填“偏大”“偏小”或“不变”,下同).
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q偏小.
| 反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/kJ•mol-1 | |
| 硫酸 | 碱溶液 | |||
| ①0.5 mol•L-1 H2SO4溶液50 mL、1.0 mol•L-1 NaOH溶液50 mL | 25.1 | 25.1 | △H1 | |
| ②0.5 mol•L-1 H2SO4溶液50 mL、1.1mol•L-1 NH3•H2O溶液50 mL | 25.1 | 25.1 | △H2 | |
(2)甲同学预计△H1≠△H2,其依据是NH3•H2O是弱电解质,存在电离平衡,电离过程是吸热程.
(3)上表中终了温度为反应过程中混合溶液的最高温度(填“最高温度”或“平均温度”).
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热△H偏大(填“偏大”“偏小”或“不变”,下同).
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q偏小.
17.用下列物质冶炼相应金属时采用电解法的是( )
| A. | Fe2O3 | B. | Ag2O | C. | Cu2S | D. | Al2O3 |
18.下列关于元素周期律和元素周期表的说法中错误的是( )
| A. | 元素周期律的实质是元素原子的核外电子排布呈周期性变化 | |
| B. | 利用元素周期律可以预测元素及其化合物的性质 | |
| C. | 元素周期表有7个横行,也就是7个周期 | |
| D. | 元素周期表有18个纵列,也就是18个族 |
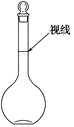 实验室配制500mL 0.2mol/L的Na2SO4溶液,实验操作步骤有:
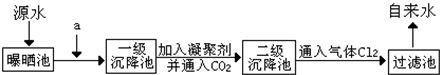
实验室配制500mL 0.2mol/L的Na2SO4溶液,实验操作步骤有: 水是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,为了探究水质优劣,某综合实验小组来自来水厂参观,了解到源水处理成自来水的工艺流程示意图如图所示:
水是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,为了探究水质优劣,某综合实验小组来自来水厂参观,了解到源水处理成自来水的工艺流程示意图如图所示: