题目内容
(16分)Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
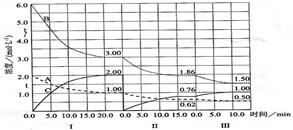
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
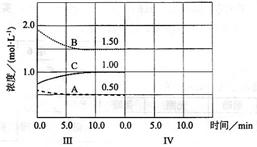
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
① 2H2 (g)+CO(g) CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
(5)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
① 2H2 (g)+CO(g)
 CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1② 2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1③ CO(g)+H2O(g)
 CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
| A.高温高压 |
| B.加入催化剂 |
| C.减少CO2的浓度 |
| D.增加CO的浓度E.分离出二甲醚 |
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.44 | 0.60 | 0.60 |
(16分)

(2)2CO2+2H2O+4e-=2CO+4OH- (2分)
Ⅱ.(3)3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1(3分)
CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1(3分)
(4)C E (2分) ;
(5)>(1分)

(2)2CO2+2H2O+4e-=2CO+4OH- (2分)
Ⅱ.(3)3H2(g)+3CO(g)
 CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1(3分)
CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1(3分)(4)C E (2分) ;
(5)>(1分)
I(1)①由图分析可得,达到平衡时△c(CH3OH)==△c(CO2)="=" 0.75mol/L,在同一化学反应方程式中,速率之比=变化量之比=化学计量数之比,所以得
②由图2可知,温度升高逆反应速率、正反应速率同时增大,但逆反应速率增大的更快,平衡向逆反应方向移动,即升高温度平衡向逆反应方向(吸热反应方向)移动,固该反应的正反应为放热反应。
③根据化学反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度 1 3 0 0
变化浓度 0.75 2.25 0.75 0.75
平衡浓度 0.25 0.75 0.75 0.75

由于该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,即升高温度k减小;
④500℃达平衡时,CH3OH的体积分数ω
(2)该电化学装置为电解装置,利用总方程式减去阳极电极反应便可得到阴极电极反应:
2CO2+2H2O+4e-=2CO+4OH-
Ⅱ.(3)由盖斯定律得总反应热化学方程式为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1
CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1
(4)要提高CO的转化率即使化学平衡向正反应方向移动,可采取的措施:C E
(5)2CH3OH(g) CH3OCH3(g)+H2O(g)的
CH3OCH3(g)+H2O(g)的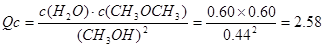 <K=400,所以反应向正反应方向进行,即v (正)>v (逆)
<K=400,所以反应向正反应方向进行,即v (正)>v (逆)

②由图2可知,温度升高逆反应速率、正反应速率同时增大,但逆反应速率增大的更快,平衡向逆反应方向移动,即升高温度平衡向逆反应方向(吸热反应方向)移动,固该反应的正反应为放热反应。
③根据化学反应方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度 1 3 0 0
变化浓度 0.75 2.25 0.75 0.75
平衡浓度 0.25 0.75 0.75 0.75

由于该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,即升高温度k减小;
④500℃达平衡时,CH3OH的体积分数ω

(2)该电化学装置为电解装置,利用总方程式减去阳极电极反应便可得到阴极电极反应:
2CO2+2H2O+4e-=2CO+4OH-
Ⅱ.(3)由盖斯定律得总反应热化学方程式为:
3H2(g)+3CO(g)
 CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1
CH3OCH3(g)+CO2 (g) ΔH =-246.4 kJ·mol-1(4)要提高CO的转化率即使化学平衡向正反应方向移动,可采取的措施:C E
(5)2CH3OH(g)
 CH3OCH3(g)+H2O(g)的
CH3OCH3(g)+H2O(g)的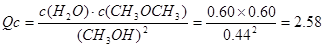 <K=400,所以反应向正反应方向进行,即v (正)>v (逆)
<K=400,所以反应向正反应方向进行,即v (正)>v (逆)
练习册系列答案
相关题目
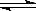 B(g)+2C(g),增大压强反应速率加快,A的转化率减小
B(g)+2C(g),增大压强反应速率加快,A的转化率减小 。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
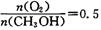 时,制备反应分两步进行,其中一步是
时,制备反应分两步进行,其中一步是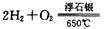
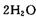 ,则另一步是____________ (写化学方程式)。
,则另一步是____________ (写化学方程式)。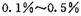 的HCHO可用于杀菌消毒,其原因是________。
的HCHO可用于杀菌消毒,其原因是________。 还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧
还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧 化物是NO2,碳氢化合物是CxHy
化物是NO2,碳氢化合物是CxHy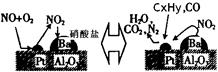
 2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠ ①常温下,反应2H2O(g) 2H2(g)
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K= ;
+O2(g) 平衡常数K= ; 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2
常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 CO(g)+3H2(g);△H=+206.lkJ·mol-l。
CO(g)+3H2(g);△H=+206.lkJ·mol-l。
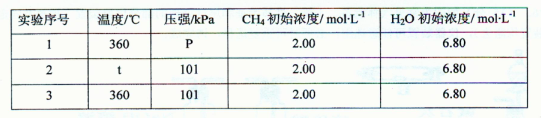
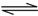 2NH3(g)的△H= 。
2NH3(g)的△H= 。 积分数为 。
积分数为 。
 内外
内外 上发生的电极反应式是 。
上发生的电极反应式是 。  cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示: