��Ŀ����
����˵������ȷ����
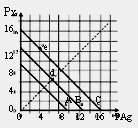
| A��������ˮ��ԭ����Al3+ˮ�����Al(OH)3���壬Al(OH)3����������ˮ�е��������ʣ���ʹ֮���� |
| B��Ħ���ε��Ʊ�ԭ��Ϊ��6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O����Ӧ֮�����ܽ��е�ԭ����(NH4)2Fe(SO4)?6H2O�ܽ����С |
| C����п��Ƥ�������ܽ⣬���Ʋ㷴Ӧ��ȫʱ���������������ʻ�ͻȻ���� |
| D�������ͷֱ�ӽ���Ʒ����Һ�У����Լ�����ͷ���Ƿ�����Ԫ�� |
D
�𰸣�D
A����ȷ��������ˮ��ԭ����Al3+ˮ�����Al(OH)3���壬Al3����3H2O
 Al(OH)3��3H�� ,Al(OH)3����������ˮ�е��������ʣ���ʹ֮����
Al(OH)3��3H�� ,Al(OH)3����������ˮ�е��������ʣ���ʹ֮����B����ȷ��Ħ���ε��Ʊ�ԭ��Ϊ��6H2O+FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)?6H2O����Ӧ֮�����ܽ��е�ԭ����(NH4)2Fe(SO4)?6H2O�ܽ����С���ﵽ���ͺ��ܴ���Һ��������
C����ȷ����п��Ƥ�������ܽ⣬���Ʋ㷴Ӧ��ȫʱ�������γ�ԭ��أ���Ӧ���ʱ������������������ʻ�ͻȻ����
D������ȷ�������ͷֱ�ӽ���Ʒ����Һ�У���������ͷ���Ƿ�����Ԫ�أ��ɽ���ȼ�պ����ɵ�����ͨ��Ʒ����Һ��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ

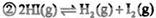
 CH3OH(g)��H2O(g) ��
CH3OH(g)��H2O(g) ��
 CH3OH (g) ��H����90.8 kJ��mol-1
CH3OH (g) ��H����90.8 kJ��mol-1 2SO3��g�� ��H����196.6 kJ��mol-1
2SO3��g�� ��H����196.6 kJ��mol-1

 2H2����O2��
2H2����O2�� 2H2����O2��
2H2����O2�� 2H2����O2��
2H2����O2�� CO��3H2
CO��3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)