题目内容
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
| A.电子通过外电路从b极流向a极 |
| B.每转移0.1mol电子,消耗1.12L的H2 |
| C.b极上的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| D.H+由a极通过固体酸膜电解质传递到b极 |
D
解析试题分析: A、因氢元素的化合价升高,则a为负极,这样电子应该是通过外电路由a极流向b,故A错;
B、因没有说明是否为标准状况,则气体的体积不一定为1.12L,,故B错;
C、该电池为酸性电池,反应为O2+4e-+4H+=2H2O故C错;
D、原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D正确.
考点:考查燃料电池的工作原理

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH > a,则该电解质可能是
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
某实验兴趣小组设计如下微型实验装置。实验时,先断开S2,闭合S1,两极均有气泡产生;一段时间后,断开S1,闭合S2,发现电流表A的指针偏转,下列有关描述正确的是
A.断开S2闭合S1时,总反应的离子方程式为:2H++2Cl- H2↑+Cl2↑ H2↑+Cl2↑ |
| B.断开S2闭合S1时,阳极附近溶液变红 |
| C.断开S1闭合S2时,铜电极上的电极反应为:Cl2+2e→2Cl- |
| D.断开S1闭合S2时,石墨电极作正极 |
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl 下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl——e—=AgCl |
| B.AgCl是还原产物 |
| C.Na+不断向“水”电池的负极移动 |
| D.每生成1 mol Na2Mn5O10转移2 mol电子 |
如图是一电池,下列有关说法正确的是
A.该电池负极反应为:2Fe2+-2e- 2Fe3+ 2Fe3+ |
| B.当有6.02×1023电子转移时,Fe电极减少56g |
| C.石墨电极上发生氧化反应 |
| D.盐桥中K+移向FeCl3溶液 |
等物质量浓度的FeBr3和CuCl2的混合溶液用惰性电极电解最初在负极发生反应的离子是( )
| A.Fe3+ | B.Br- | C.Cu2+ | D.Cl- |
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,
下列叙述正确的是
| A.电解时可以精铜为阳极,以CuSO4溶液为电解液 |
| B.电解时阴极发生还原反应 |
| C.粗铜连接电源负极,其电极反应是Cu-2e—=Cu2+ |
| D.电解结束后,电解质溶液的浓度保持不变 |
发展混合动力车是实施节能减排的重要措施之一。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液。镍氢电池充放电原理总反应式为:H2+2NiOOH 2Ni(OH)2。下列有关混合动力车的判断正确的是:
2Ni(OH)2。下列有关混合动力车的判断正确的是: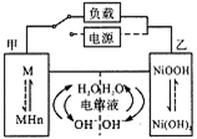
| A.在上坡或加速时,乙电极周围溶液的pH将减小 |
| B.在上坡或加速时,溶液中的K+向甲电极迁移 |
| C.在刹车和下坡时,乙电极增重 |
D.在刹车和下坡时,甲电极的电极反应式为:2H2O+2e- H2↑+2OH- H2↑+2OH- |
