题目内容
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO__FeO(填“>,<或=”),原因是_________。
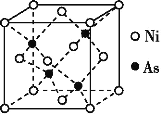
(3)NiAs的晶胞结构如图所示:
①Ni的配位数为____。
②若阿伏伽德罗常数的值为NA,晶体密度为ρ g·cm-3,则该晶胞中最近的Ni之间的距离为______cm。(写出计算表达式)。
【答案】分子晶体 5 > 离子所带电荷数相同时,离子半径越小,晶格能越大,熔点越高 4 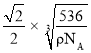
【解析】
(1)易溶于非极性溶剂,熔沸点较低,可判断为分子晶体;配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,一个CO提供两个电子,则8+2x=18,求出x;
(2)NiO、FeO均为离子晶体,Ni2+和Fe2+电荷数相同,离子半径越小,晶格能越大,熔点越高;
(3)先通过晶体的密度,求出晶胞的边长,再根据立体几何知识,晶胞中最近的两个Ni的距离为l=![]() a。
a。
(1)Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,熔沸点较低,可判断为分子晶体;若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,一个CO提供两个电子,则8+2x=18,所以x=5,故答案为:分子晶体;5;
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,均为离子晶体,Ni2+和Fe2+电荷数相同,离子半径越小,晶格能越大,熔点越高,所以熔点NiO>FeO,故答案为:>;相同电荷的离子,半径越小,离子间的静电作用力越大,离子晶体的晶格能越大;
(3)①根据NiAs晶胞结构分析,Ni做面心立方最密堆积,As做四面体填隙,所以镍离子的配位数为4,故答案为:4;
②一个NiAs晶胞中,含有Ni的数目为8×![]() +6×
+6×![]() =4个,含有As的数目为4个,不妨取1mol这样的晶胞,则有NA个晶胞,1mol晶胞的质量为m=4×134g=536g,一个晶胞的体积为V=a3cm3,所以晶体密度为ρ=
=4个,含有As的数目为4个,不妨取1mol这样的晶胞,则有NA个晶胞,1mol晶胞的质量为m=4×134g=536g,一个晶胞的体积为V=a3cm3,所以晶体密度为ρ=![]() g·cm-3,则晶胞边长为a=
g·cm-3,则晶胞边长为a=![]() cm,根据立体几何知识,晶胞中最近的两个Ni的距离为l=
cm,根据立体几何知识,晶胞中最近的两个Ni的距离为l=![]() a,则该晶胞中最近的Ni之间的距离为
a,则该晶胞中最近的Ni之间的距离为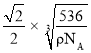 cm。故答案为:
cm。故答案为: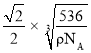 。
。

【题目】某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易升华;③淀粉溶液遇到碘单质变蓝色;④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
水 | 四氯化碳 | |
溴 | 黄→棕 | 橙→橙红 |
碘 | 深黄→褐 | 紫→深紫 |
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)

实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
(1)验证氯气的氧化性强于碘的实验现象是____________________________,写出该反应的化学方程式__________________________________;
(2)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________,写出该反应的离子方程式_______________________;
(3)由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为____________;
(4)你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点______________
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)铁晶体有两种晶胞,如图1、图2所示。
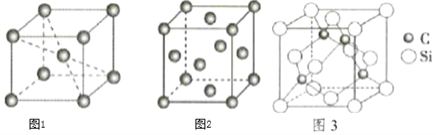
图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
【题目】下表列出了①~⑨九种元素在周期表中的位置,A、B和C是中学常见的化合物,回答问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)上述所列元素中,最高价氧化物的水化物的酸性最强的是________(填化学式)。
(2)②元素最高正价与④元素形成的化合物的电子式是__________。
(3)⑤⑨两种元素形成氢化物的水溶液的酸性由弱到强的顺序为________(用化学式表示)。
(4)从④⑥两种元素形成的化合物与④⑧两种元素形成的化合物的混合物中分离提纯④⑧两种元素形成的化合物,可加入上表中________(用元素符号表示)两种元素形成的化合物的水溶液后,再过滤洗涤。
(5)③元素的气态氢化物与其最高价氧化物的水化物反应生成的物质为________(用化学式表示),该物质所含化学键类型有________________。





