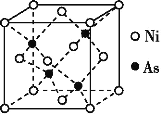
题目内容
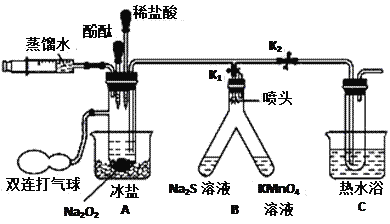
【题目】实验室在模拟工业制备和提纯硅时,利用氯气、石英砂和碳粉等原料按以下装置制备了SiCl4。已知SiCl4熔点-70°C,沸点57.6°C,遇水极易水解。

下列说法不正确的是( )
A.实验所用氯气等原料必须预先干燥处理
B.两通管中发生的化学反应为SiO2+C+2Cl2![]() SiCl4+CO2
SiCl4+CO2
C.液体X的作用是液化SiCl4气体,可以选择冰水等作冷却剂
D.若缺少固体Y的装置,实验时Z中可能会出现大量的白色烟雾
【答案】B
【解析】
A.SiCl4遇水极易水解,所以制备装置和收集装置中都要保持干燥,所用氯气等原料必须预先干燥处理,故A正确,不选;
B.根据C与二氧化硅反应生成硅单质和CO可知两通管中C应被氧化生成CO,化学方程式为SiO2+2C+2Cl2![]() SiCl4+2CO,故B错误,符合题意;
SiCl4+2CO,故B错误,符合题意;
C.SiCl4熔沸点较低,所以反应生成的SiCl4应为气体,在装置Z中冷凝生成SiCl4液体,X可以选用冰水等作冷却剂,故C正确,不选;
D.若缺少固体Y的装置,尾气处理装置中的水蒸气进入装置Z造成SiCl4水解产生白色烟雾,故D正确,不选;
答案为B。

【题目】![]() 时,2L密闭容器中充入
时,2L密闭容器中充入![]()
![]() ,发生反应:
,发生反应:![]() ,获得如下数据:下列判断正确的是
,获得如下数据:下列判断正确的是![]()
时间 | 0 | 20 | 40 | 60 | 80 | 100 |
|
|
|
|
|
|
|
A.![]() 内,
内,![]()
B.在相同条件下,开始时若向容器中充入的是![]()
![]() ,达到平衡后
,达到平衡后![]() 的转化率为
的转化率为![]()
C.反应达平衡时,吸收的热量为![]() kJ
kJ
D.100s时再通入![]() mol
mol![]() ,达新平衡时
,达新平衡时![]() 的转化率增大
的转化率增大
【题目】(Ⅰ)某化学反应A![]() B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)该反应属于__________反应(填“可逆”或“不可逆”)。
(2)在实验1、2中,有一个实验使用了催化剂。请你利用表中数据判断实验___(填1或2)使用了催化剂,理由是_______________。
(3)该实验表明,影响化学反应速率的因素还有__________。
(II)下图是1molNO2和1molCO反应生成1molCO2和1molNO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________。

该反应的活化能等于____________________