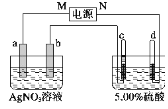
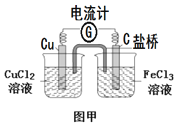
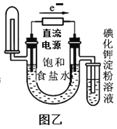
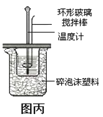
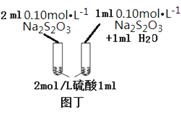
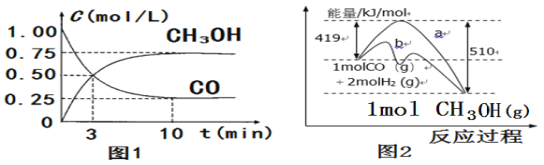
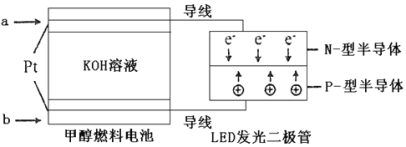
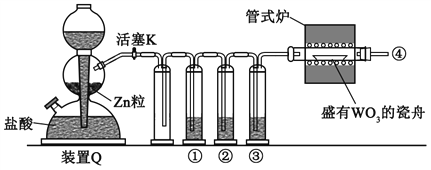
题目内容
【题目】某元素的原子最外层电子排布式是![]() ,该元素或其单质不可能具有的性质是( )
,该元素或其单质不可能具有的性质是( )
A.该元素的金属性比铝元素的强
B.该元素的单质在一定条件下能与盐酸反应
C.该元素位于第五周期ⅢA族
D.该元素的最高化合价为+5
【答案】D
【解析】
原子最外电子层排布是![]() ,应位于周期表第五周期第IIIA族,为In元素,最外层电子数为3,金属性较强,在化学反应中易失去电子,最高化合价为+3价,以此解答该题。
,应位于周期表第五周期第IIIA族,为In元素,最外层电子数为3,金属性较强,在化学反应中易失去电子,最高化合价为+3价,以此解答该题。
A、In元素与Al元素同主族,从上到下金属性增强,故In元素的金属性比Al强,故A正确;
B、In元素的金属性比Al强,故可以和盐酸反应,故B正确;
C、该元素最外电子层排布是![]() ,位于周期表第五周期第IIIA族,故C正确;
,位于周期表第五周期第IIIA族,故C正确;
D、该元素最外层有3个电子,最高化合价为+3价,故D错误。
答案选D。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】实验室制备 1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如下图所示:
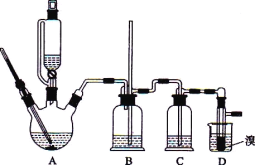
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃ 左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入_____,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量未反应的 Br2,最好用_____洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)判断该制各反应已经结束的最简单方法是_____;
(5)若产物中有少量副产物乙醚,可用_____的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是____;但又不能过度冷却(如用冰水),其原因是_____