题目内容
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
C
解析试题分析:A.水的电离是个吸热过程。升高温度,促进水的电离。所以Kw增大,c(H+)增大,pH减小。但是由于水电离产生的H+和OH-的个数相等,所以溶液仍然为中性。错误。B.向纯水中加入稀氨水,由于氨水为碱性,c(OH-)增大,水的电离平衡逆向移动,水对氨水起到稀释作用, c(OH-)减小,由于Kw只与温度有关温度不变,所以,KW不变。错误。C.向纯水中加入少量固体碳酸钠由于碳酸钠是强碱弱酸盐,CO32-会发生水解反应,消耗H+。使c(H+)减小, 由于Kw只与温度有关温度不变,所以,KW不变。正确。D.向纯水中加入醋酸钠,由于醋酸钠是强碱弱酸盐,醋酸根离子会发生水解反应,消耗水电离产生的H+,促进水的电离,最终溶液显碱性。当向水中加入盐酸,HCl电离产生大量的H+,会对水的电离起到抑制作用,使水的电离程度减小。但是由于Kw只与温度有关温度不变,所以,KW不变。错误。
考点:考查各种外界条件对水的电离平衡及Kw的影响的知识。

将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
| A.溶液的pH增大 | B.CH3COOH电离的百分率变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是
| A.②中由水电离出的c(H+)=1×10-12mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
下列有关说法中正确的是
| A.常温下,将1 L pH=12的氨水加水稀释为10 L后溶液的pH=11 |
| B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲) |
C.向浓度均为0.1 mol·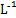 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 |
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是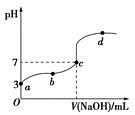
| A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1 |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中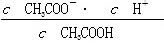 相等 相等 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。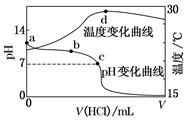
下列有关说法正确的是( )
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
B.b点:c(NH )+c(NH3·H2O)=c(Cl-) )+c(NH3·H2O)=c(Cl-) |
C.c点:c(Cl-)=c(NH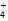 ) ) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )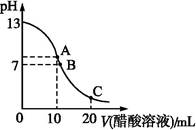
| A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |