题目内容
常温下,下列各组比值为1∶2的是 ( )
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c (CH3COO-)之比 |
D
解析试题分析:A.在相同的温度下,弱酸的浓度越大,电离程度越小。所以0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)>1∶2。错误。B.Na2CO3是强碱弱酸盐,弱酸根离子CO32-会发生水解反应而消耗,所以0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)<1:2.错误。C.pH=10的Ba(OH)2溶液,c(H+)=10-10mol/L,c(OH-)= 10-4mol/L.c(Ba(OH)2)= 1/2×10-4mol/L.pH=10的氨水c(NH3)>>10-4mol/L.因此pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比<1:2.错误。D.在溶液中存在电离:H2SO4=2H++SO42-;CH3COOH CH3COO-+H+。若pH=3,则c(H+)=10-3mol/L,c(SO42-)=1/2×10-3mol/L; (CH3COO-)= c(H+)=10-3mol/L,.所以溶液硫酸与醋酸溶液,c(SO42-)与c (CH3COO-)之比=1:2.正确。
CH3COO-+H+。若pH=3,则c(H+)=10-3mol/L,c(SO42-)=1/2×10-3mol/L; (CH3COO-)= c(H+)=10-3mol/L,.所以溶液硫酸与醋酸溶液,c(SO42-)与c (CH3COO-)之比=1:2.正确。
考点:考查弱酸的电离、盐的水解及强弱电解质的溶液中的离子的浓度的关系的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列说法正确的是
| A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变 |
| B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用 |
| C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) |
D.常温下0.1 mol·L-1的HA溶液中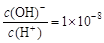 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1 |
将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
| A.溶液的pH增大 | B.CH3COOH电离的百分率变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
| A.c(H+)=c(CHCOO-)+c(OH-) |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
下列四种溶液中,水的电离程度最大的是( )
| A.pH=5的NH4Cl溶液 |
| B.pH=5的NaHSO4溶液 |
| C.pH=8的CH3COONa溶液 |
| D.pH=8的NaOH溶液 |
下列关于电解质溶液的叙述正确的是
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ<HY< HX |
| B.在HZ中加入NaOH至恰好完全反应时,溶液中各离子浓度大小顺序: c(Na+)>c(Z-)>c(OH—)>c(H+) |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)+c(Y—)+c(OH—)= c(Na+)+c(H+) |
| D.将HX和HZ溶液混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)= c(X—)+ c(Z—) |
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是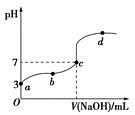
| A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1 |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中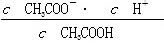 相等 相等 |
在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp) )=(Ksp) |
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO )=Ksp,c(Ba2+)>c(SO ) ) |
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO )>Ksp,c(Ba2+)=c(SO ) ) |
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO )≠Ksp,c(Ba2+)<c(SO ) ) |