题目内容
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A.-488.3 kJ/mol | B.+488.3 kJ/mol |
| C.-191 kJ/mol | D.+191 kJ/mol |
A
由题意可知:C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol ①
H2(g)+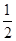 O2(g)=H2O(l)ΔH=-285.8 kJ/mol ②
O2(g)=H2O(l)ΔH=-285.8 kJ/mol ②
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH=-870.3 kJ/mol ③
①×2+②×2-③即得:
2C(s)+2H2(g)+O2(g)=CH3COOH(l)ΔH=-488.3 kJ/mol。
H2(g)+
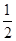 O2(g)=H2O(l)ΔH=-285.8 kJ/mol ②
O2(g)=H2O(l)ΔH=-285.8 kJ/mol ②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH=-870.3 kJ/mol ③
①×2+②×2-③即得:
2C(s)+2H2(g)+O2(g)=CH3COOH(l)ΔH=-488.3 kJ/mol。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
 H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是