��Ŀ����
����Ŀ��ij�������÷�ͭ��������������Ϊԭ�������������������£�

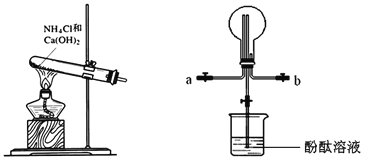
��1���������������������һ����Ҫ�Ļ���ԭ�ϣ��Ʊ���������Ҫͨ���������̣�����NH3��Ϊԭ�ϵĸù��̷�Ӧ��ѧ����ʽΪ____________________����HNO3��������________������������ڹ�ҵ������Ũ��������SO3����ֱ����H2O���յ�ԭ����____________________
��2������ʱϡ�����Cu��Ӧ�����ӷ���ʽΪ______________________________________
��3�����Ƶõĵ����м���Ũ������ɰ�ɫ���ʣ��˹���������Ũ�����_____________�ԡ�
���𰸡�4NH3��5O2 ![]() 4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO N2O5 SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3������ 3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O ��ˮ
4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO N2O5 SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3������ 3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O ��ˮ
��������
�ɻ�ѧ�������̿�֪����ͭ���е�����ͭ��ϡ���ᡢϡ���ᷴӦ��������ͭ��NO��ˮ����Ӧ����ʽΪ3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O�������Һ�м�������ͭ������Һ��pH��ʹ������ת��ΪFe��OH��3���������ˣ���������Ҫ�ɷ�ΪFe��OH��3����ҺΪ����ͭ��Һ������ͭ��Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�������
��1����ҵ���ð����Ʊ�����Ĺ���Ϊ�������ڴ��������£����������ȷ�Ӧ��������һ��������ˮ����Ӧ�Ļ�ѧ����ʽΪ4NH3��5O2 ![]() 4NO��6H2O��һ��������������Ӧ���ɶ�����������Ӧ�Ļ�ѧ����ʽΪ2NO+O2=2NO2������������ˮ��Ӧ���������һ����������Ӧ�Ļ�ѧ����ʽΪ3NO2+H2O=2HNO3+NO�����������Ϊ��������������ѧʽΪN2O5����SO3��H2O����ʱ����Ӧ�ų������ȣ���ˮ����SO3ʱ�����γ������������ٶȼ�����������SO3�����գ����Թ�ҵ������Ũ��������SO3����ֱ����H2O���գ��ʴ�Ϊ��4NH3��5O2
4NO��6H2O��һ��������������Ӧ���ɶ�����������Ӧ�Ļ�ѧ����ʽΪ2NO+O2=2NO2������������ˮ��Ӧ���������һ����������Ӧ�Ļ�ѧ����ʽΪ3NO2+H2O=2HNO3+NO�����������Ϊ��������������ѧʽΪN2O5����SO3��H2O����ʱ����Ӧ�ų������ȣ���ˮ����SO3ʱ�����γ������������ٶȼ�����������SO3�����գ����Թ�ҵ������Ũ��������SO3����ֱ����H2O���գ��ʴ�Ϊ��4NH3��5O2 ![]() 4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��N2O5��SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3�����գ�
4NO��6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��N2O5��SO3��H2O����ʱ���ų������ȡ�����ˮ��ϡ���������ռ�ʱ�����γ������������ٶȼ�����������SO3�����գ�
��2��ϡ�����Cu��Ӧ��������ͭ��һ��������ˮ����Ӧ�����ӷ���ʽΪ3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O���ʴ�Ϊ��3Cu��2NO3-+8H+��3Cu2+��2NO����4H2O��
��3��Ũ���������ˮ�ԣ��ܹ�ʹ����ʧȥ�ᾧˮ������ˮ����ͭ���ʴ�Ϊ����ˮ�ԡ�

 ��У����ϵ�д�
��У����ϵ�д�