题目内容
【题目】2SO2(g)+O2(g)2SO3(g),反应过程的能量变化如图所示.
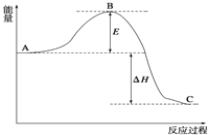
已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.
请回答下列问题:
(1)E的大小对该反应的反应热 ______ 影响?(填“有”或“无”).该反应通常用V2O5作催化剂,加V2O5会使图中B点 ______ (填“升高”或“降低”);
(2)图中△H= ______ kJ/mol;
(3)如果反应速率υ(SO2)为0.05mol/(Lmin),则υ(O2)= ______ mol/(Lmin);
(4)1molSO2(g)氧化为1molSO3(g)的反应热△H1 ______ 1molSO3(g)还原为1molSO2(g)的反应热△H2(填“>、<或=”) 。
(5)已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3molSO3(l)的△H= _________________
【答案】无降低-1980.025<-1185 kJ/mol
【解析】
(1)因图中A、C分别表示反应物总能量、生成物总能量,E为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变,故答案为:无;降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198kJmol-1,故答案为:-198;
(3)反应的化学方程式为:2SO2(g)+O2(g)2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05 mol/(Lmin),依据比例计算得到v(O2)=0.025mol/(Lmin), 故答案为:0.025;
(4)二氧化硫氧化生成三氧化硫的反应为放热反应,△H<0,其逆过程为吸热反应,△H>0,因此1molSO2(g)氧化为1molSO3(g)的反应热△H1 小于1molSO3(g)还原为1molSO2(g)的反应热△H2,故答案为:<;
(5)单质硫的燃烧热为296kJmol-1,热化学方程式为:①S(s)+O2(g)=SO2(g) △H1=-296 KJmol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,热化学方程式为②SO2(g)+1/2O2(g)SO3(g) △H2=-99 kJmol-1 ;依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g) △H=(△H1+△H2)kJ/mol;计算由S(s)生成3molSO3(g)③×3得到:3 S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185 kJmol-1,故答案为:-1185 kJmol-1。

【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是
选项 | 化学反应 | 测量依据(单位时间内) |
A | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | 2NO2(红棕色)N2O4(无色) | 颜色深浅 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
A. A B. B C. C D. D