题目内容
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①:①③相连时,③为正极:②④相连时,②上有气泡逸出:③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
B
解析试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可以判断金属性强弱顺序。①②相连时,外电路电流从②流向①,这说明②是正极,①是负极,因此金属性是①>②;①③相连时,③为正极,所以①是负极,则金属性是①>③:②④相连时,②上有气泡逸出,这说明②是正极,④是负极,则金属性是④>2:③④相连时,③的质量减少,这说明③是负极,④是正极,因此金属性是③>④,据此可知这四种金属活动性由大到小的顺序是①③④②,答案选B。
考点:考查根据原电池判断金属性强弱

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
| A.正极附近的SO42-离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
用惰性电极电解50 mL锰酸钾溶液:K2MnO4+H2O→KMnO4+H2↑+KOH(未配平),当生成112 mL氢气(标准状况)时停止通电。下列判断正确的是 ( )
| A.K+浓度减小 | B.KMnO4在阳极区生成 |
| C.阴极周围溶液的pH减小 | D.反应过程中共转移0.005mol电子 |
用惰性电极电解下列足量溶液,一段时间后,再加入一定量的另一种物质(括号内物质),溶液与原来溶液完全一样的是 ( )
| A.NaCl(盐酸) | B.NaOH(NaOH) | C.AgNO3(Ag2O) | D.CuSO4[Cu(OH)2] |
如下各图烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为 ( )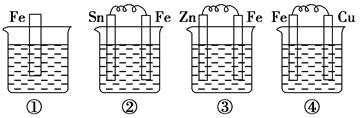
| A.②①③④ | B.④③②① |
| C.④②①③ | D.③②④① |
下列拟采用的金属防腐措施,错误的是
| A.给金属衣架或电线外面包上一层塑料层 |
| B.给自行车钢圈镀上一层金属铬 |
| C.在轮船的外表面焊上一些铜块 |
| D.给铁栅栏表面涂上一层油漆? |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
关于右图装置的叙述,正确的是( )
| A.铝是负极,铝片上析出无色气体 |
| B.溶液中两电极间产生白色沉淀 |
| C.溶液中先产生白色沉淀,最后沉淀溶解 |
| D.石墨是正极,石墨棒上析出黄绿色气体 |

