题目内容
用惰性电极电解下列足量溶液,一段时间后,再加入一定量的另一种物质(括号内物质),溶液与原来溶液完全一样的是 ( )
| A.NaCl(盐酸) | B.NaOH(NaOH) | C.AgNO3(Ag2O) | D.CuSO4[Cu(OH)2] |
C
解析试题分析:A.惰性电极电解氯化钠溶液,电极生成物是氯气、氢气和氢氧化钠,所以需要加入的是氯化氢,故A错误。B.惰性电极电解氢氧化钠溶液,实质是电解水,加入的应该是水,故B错误。C.电解AgNO3溶液生成Ag和氧气,需要加入的是Ag2O,故C正确。D.惰性电极电解硫酸铜溶液,生成物是铜、氧气和硫酸,所以需要加入的是氧化铜或碳酸铜,故D错误。
考点:电解原理

关于下列各装置图的叙述不正确的是( )
① ② ③ ④
| A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B.图②装置的盐桥中KCl的Cl—移向甲烧杯 |
| C.图③装置中钢闸门应与外接电源的正极相连获得保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。她的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传到Li+的高分子材料。这种锂离子电池反应式为:Li + 2Li0.35NiO2=" 2" Li0.85NiO2
下列说法不正确的是 ( )
| A.放电时,负极的电极反应式:Li -e- = Li+ |
| B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C.该电池不能用水作为电解质 |
| D.放电过程中Li+ 向负极移动 |
某种能与稀盐酸反应放出H2的金属与锌组成原电池时,锌为负极,则此金属可能是
| A.Mg | B.Fe | C.Al | D.Cu |
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
| D.铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e- = Fe3+,继而形成铁锈 |
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,则下列说法不正确的是 ( )
| A.电源a极为负极 |
| B.KI—淀粉溶液会变蓝 |
| C.可以将惰性电极Ⅰ换为铜棒 |
| D.惰性电极Ⅰ上发生的电极反应为:Cu-2e-=Cu2+ |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①:①③相连时,③为正极:②④相连时,②上有气泡逸出:③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
用惰性电极在一定温度下电解某Na2SO4饱和溶液,当两极共产生标准状况下67.2L气体时,从溶液中析出64.4g Na2SO4?10H2O 晶体。则剩余溶液的溶质质量分数约是
| A.64.7% | B.47.5% | C.32.2% | D.28.3% |
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如下图。经过一段时间后,首先观察到溶液变红的区域是( )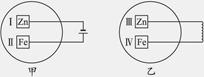
| A.Ⅰ和Ⅲ附近 | B.Ⅰ和Ⅳ附近 |
| C.Ⅱ和Ⅲ附近 | D.Ⅱ和Ⅳ附近 |