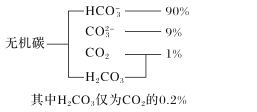
题目内容
【题目】工业上以软锰矿(主要成分为MnO2,另含有少量FeCO3、Al2O3、SiO2)为原料制取金属锰的工艺流程如下:

(1)写出“浸渣”中主要成分的用途 ________(写出两条)。
(2)滤渣1的主要成分是 ________(用化学式表示)
(3)经检测“浸取液”中无Fe2+,“浸取”时MnO 2发生反应的离子方程式为 ________。
(4)写出“沉锰”操作中发生反应的离子方程式:________。
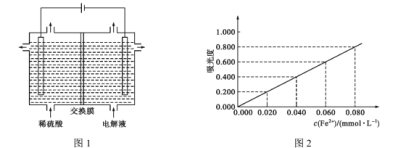
(5)将“酸溶”后的溶液作为电解液,用下图1装置电解,应采用 ______(填“阴”或“阳”)离子交换膜,阳极的电极反应式为________。
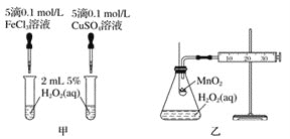
(6)为充分利用“滤渣1”,需测定滤渣中铝元素的含量,设计以下方案。
①将ag滤渣处理成xmL溶液。
②取少量①中溶液用EDTA滴定测得溶液中Fe3+ 、Al3+ 的浓度之和为ymmol·L-1 。
③另取少量①中溶液将Fe3+ 用盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl- )还原为Fe2+,离子方程式为 ________;
④将③所得溶液利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如上图2所示)。该样品中铝元素的质量分数为 _________(用含字母的表达式表示)。
【答案】制造玻璃、光导纤维; Al(OH)3; MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O; Mn2++2HCO3-=MnCO3↓+H2O+CO2↑; 阴; 2H2O-4e-=4H++O2↑; 2Fe3++2NH3OH+=2Fe2++4H++N2↑+2H2O; ![]() 。
。
【解析】
软锰矿制取金属锰的工艺流程图,结合软锰矿的成分及性质、加入的物质,判断浸取、除杂、沉锰、酸溶、电解等步骤发生的反应,可确定“浸渣”中主要成分为二氧化硅;根据吸光度与Fe2+的浓度关系图,确定吸光度为0.400时的c(Fe2+),再结合EDTA滴定,测得结果确定c(Al3+),从而求出样品中m(Al)及Al元素的质量分数。
(1)写出“浸渣”中主要成分为二氧化硅,所以用途为制造玻璃、光导纤维;
(2)浸取液中含有Al3+,加入碳酸钠,碳酸根和铝离子发生双水解,产生氢氧化铝沉淀,所以滤渣1的主要成分是Al(OH)3;
(3)经检测“浸取液”中无Fe2+,则在“浸取”过程中Fe3+与MnO 2发生了反应,离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)滤液1中主要含有硫酸锰,加入碳酸氢铵,发生反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;
(5)酸溶后的溶液中含有MnSO4,左侧是阳极,电极反应式为2H2O-4e-=4H++O2↑;右侧是阴极,电极反应式为Mn2++2e-=Mn,为维持交换膜两侧电解质溶液电荷守恒,且使电解生成Mn的反应持续进行,SO42-需要透过交换膜向左例移动,故交换膜是阴离子交换膜;
(6) ③盐酸羟胺在溶液中可完全电离出NH3OH+与Cl-,将Fe3+用盐酸羟胺还原为Fe2+,NH2OH被氧化生成N2,离子方程式为2Fe3++2NH3OH+=2Fe2++4H++N2↑+2H2O;
④由题图乙可知,吸光度为0.400时,溶液中c(Fe2+)=0.040mmolL-1,用EDTA标准溶液滴定测得溶液中Fe3+、Al3+的浓度之和为b mmolL-1,则有c(Al3+)=(b-0.04)mmolL-1=(b-0.04)×10-3molL-1,样品中Al元素的质量m(Al)=(b-0.04)x10-3molL-1×27g/mol=27a(b-0.04)×10-10g,故样品中A元素的质量分数为![]() 。
。