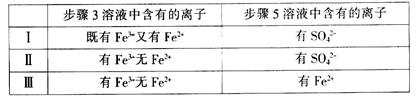
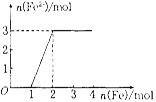题目内容
明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。
请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。
(1)KAl(SO4)2·3H2O;(2) KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
解析试题分析:(1)由图像分析可知:温度升至200℃,固体质量由4.74g变为2.58g,结合KAl(SO4)2·12H2O的摩尔质量(474 g/mol)和 KAl(SO4)2的摩尔质量(258g/mol)可知:该过程为0.01molKAl(SO4)2·12H2O失去全部结晶水转化为0.01mol KAl(SO4)2的过程,则温度升至64.5℃时为明矾晶体失去部分结晶水,即固体由KAl(SO4)2·12H2O变为KAl(SO4)2·xH2O,即KAl(SO4)2·xH2O的质量为3.12g,但固体的物质的量不变仍为0.01mol,KAl(SO4)2·xH2O的摩尔质量为312 g/mol,求得x=3,化学式为KAl(SO4)2·3H2O;(2)由(1)的分析结合图像知200℃时固体由KAl(SO4)2·3H2O变为KAl(SO4)2,发生反应的化学方程式KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
考点:考查图像分析能力及守恒法计算。

 名校课堂系列答案
名校课堂系列答案我国从澳大利亚进口的某高炉生铁(用A表示)的成分如下(其余是铁):
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
(2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数至少是 %。
(3)锰的质量分数为30%的高锰钢有很好的性能,可制作火车车轮。将A冶炼成含碳0.4%、含锰30%的高锰钢(设铁无损耗,其它杂质已除去,可补充锰),则100吨A可制得高锰钢 吨。
(4)某炼钢厂的烟尘成分和质量分数如下表:
| | FeO | Fe2O3 | CaO |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |
为了减少烟尘的排放,将烟尘与CO混合后在空气中煅烧,得到铁的氧化物和CaO的烧结物,其中CaO的质量分数为8.92%(金属元素无损耗),烧结物分离出CaO后,若铁的氧化物中只有两种物质组成,则铁的氧化物的组成和物质的量之比如何?
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。
你认为他的解释是否合理?答:__________(填“合理”或“不合理”)
(1)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,
反应的离子方程式为 。
(2)实验室溶解该熔融物,下列试剂中最好的是 (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
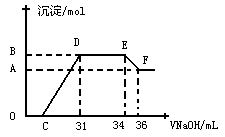
(3)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________
(4)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为__________
(5)上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(6)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为_______mL。
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):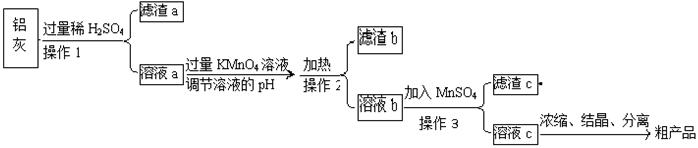
(1)滤渣a可用于制造 。
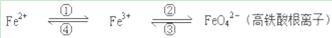
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
 和冰晶石(
和冰晶石(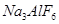 )混合熔融电解制得。
)混合熔融电解制得。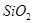 等。从铝土矿中提炼
等。从铝土矿中提炼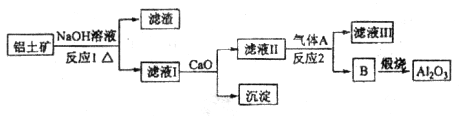
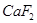 )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下:
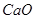 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________