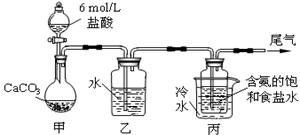
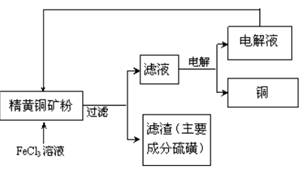
题目内容
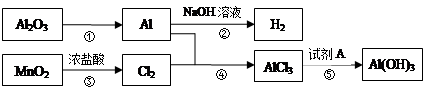
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下: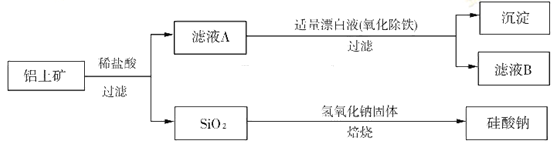
(1)滤液A所含溶质属于盐的是___________________。
(2)检验滤液B中是否还含有铁元素的方法为:_______________________________________
____________________________________________________________(注明试剂、现象)。
(3)将滤液B中的铝元素以沉淀形式析出,最佳试剂应选_____________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___________(填代号)。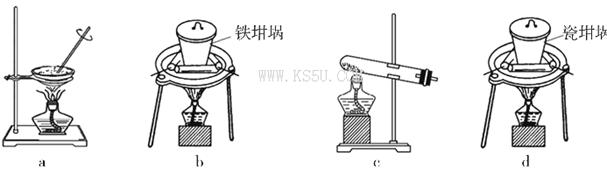
(1)AlCl3、FeCl2(2)取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。(其他合理答案均得分)(3)d (4)b
解析试题分析:(1)铝土矿和盐酸的反应为Al2O3+6HCl=2AlCl3+3H2O FeO+2HCl=FeCl2+H2O,所以滤液A所含溶质属于盐的是AlCl3、FeCl2;(2)滤液B中可能含有的铁元素以Fe3+形式存在,检验方法为:取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。(3)滤液A经氧化Fe2+转化为Fe3+,除去Fe3+后滤液B的主要成分为AlCl3溶液,要使铝元素转化为氢氧化铝沉淀最佳试剂为氨水;(4)固体的焙烧应用坩埚,氢氧化钠和陶瓷的成分二氧化硅反应生成硅酸钠的和水,所以应选用铁坩埚,选b。
考点:以铝土矿提取铝的化合物工艺流程为载体,考查铝及其化合物的性质、Fe3+的检验及二氧化硅的性质和相关化学实验基本操作。

用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。


(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)= 。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
| 物质 | Ca(OH)2 | CaSO4 | Na2SO4 |
| 溶解度/g | 0.153 | 0.258 | 19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为_________________________________。该现象的化学反应方程式为
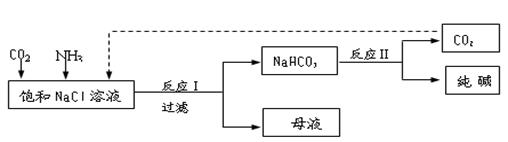 k+s-5#
k+s-5# NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下: