��Ŀ����
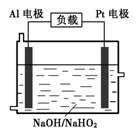
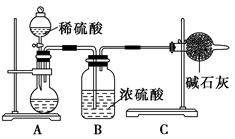
.������16�֣�Ϊ��֤�����ԣ�Cl2>Fe3+>SO2��ijС������ͼ��ʾװ�ý���ʵ�飨�г������ͼ��м���װ�����ԣ��������Ѽ��飩��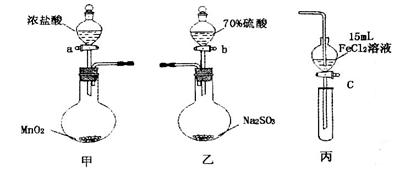
ʵ�鲽�裺
1.�ڼ�װ���У�����a�����ȣ���װ���г�������ɫ����ʱ�����װ�����ӡ�
2.����װ����FeC12��Һ���ʱ��ֹͣ���ȡ�
3.����c��ʹԼ2mL����Һ�����Թ��У�������Һ�е����ӡ�
4.����װ���У�����b���������ž������в���������ͨ��������װ�ñ�ƺ����Һ�У�һ��ʱ���ֹͣ��
5.���±����Թܣ�����c��ʹԼ2mL����Һ�����Թ��У�������Һ�е����ӡ�
�ش��������⣺
��1�����з�����Ӧ�Ļ�ѧ����ʽΪ___________________________________________��
��2����70%��������ȡSO2����Ӧ���ʱ���98%������죬ԭ����__________________��
��3��ʵ���У�֤��������Fe3+��SO2�����ӷ���ʽΪ_____________________________��
��4����I��II��III����ͬѧ�ֱ����������ʵ�飬ʵ�������£�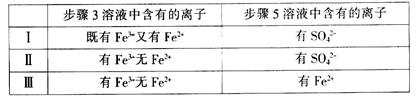
����ʵ����һ���ܹ�֤��������:Cl2>Fe3+>SO2����___________���á�I������II������III�����Żش𣩡�
��5����Ҫ�����ϼͱ�װ��֤��������Ϊ��Cl2> Fe3+> I2�Ľ��ۣ�����Ϊ��
��������©���м��������Լ�_________��_________��һ���ܼ�__________��
�ڽ���װ���в�����Cl2����ͨ����У��۲����©������Һ��ɫ�仯��
������۲쵽������Һ_______________________________________�������ȷ��
��ֹͣͨ��Cl2��
33.�𰸣�16�֣�
��1��MnO2 + 4 HCl��Ũ��= MnCl2 + Cl2��+ 2H2O �����ȣ���2�֣�����д�����ȡ�����Ũ�����÷֣�����������ſ�1�֣�
��2��70%��H2SO4��98%��H2SO4����̶ȴ���Һ��H+Ũ�ȴ�Ӧ�ٶȿ� ��2�֣���ֻ��70%��H2SO4��Һ��Һ��H+Ũ�ȴ�Ҳ�ɵ÷֣�
��3��2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO32- + 4H+��2�֣�
��4����͢� ��4�֣���2�֣�
��5����FeI2��KSCN��CCl4��3�֣�
���²㣨CCl4�㣩������ɫ��Ϊ�Ϻ�ɫ��1�֣������ϲ���Һ��dz��ɫ��1�֣���Ϊ��ɫ��1�֣���
������������� ��1�����ݼ�װ���е�������ʾ�������жϸ�װ����ʵ�����Ʊ������ķ���װ�ã����Ը�װ���з����ķ�Ӧ��MnO2 + 4 HCl��Ũ��= MnCl2 + Cl2��+ 2H2O��
��2��װ������ʵ�����Ʊ�SO2�ķ���װ�ã��÷�Ӧ��ԭ���������ѻӷ�������ǿ�������Ʊ����Խ������ֽ�������ᣬ����Ҫ�Ͽ��Ƶý϶�������ᣨSO2������Ҫ��Һ�к��е������ӵ�Ũ�Ƚϴ����Զ��ڲ�ͬŨ�ȵ�������ԣ������Ũ��С������̶�Խ��������70%��������ȡSO2����Һ��H+Ũ�ȴ�Ӧ���ʱ���98%������졣
��3������֤��������Fe3+��SO2 �����ڱ�Ƶ��Ȼ�������ͨ��SO2��SO2�ֱ�Fe3+ ���������Է�Ӧ�����ӷ���ʽΪ2Fe3+ + SO2 + 2H2O =" 2" Fe3+ + SO32- + 4H+ ��
��4��I��ͬѧ����õ��IJ���3��Һ�Ⱥ���Fe3+�ֺ���Fe2+ ��˵����Һ�е�Fe3+ �������������ã���һ�������й��������������Բ���5�м���SO42- ��Ҳһ������Fe3+ ����SO2���ã���˿��Եó�����������:Cl2>Fe3+>SO2 ��III��ͬѧ���IJ���3��Һֻ��Fe3+����Fe2+����˵����Һ�е�Fe3+ �������������ã�������5�м���Fe2+��Ҳ����˵����Һ��Fe2+ ��SO2��ԭFe3+ ���ã����Կ��Եó�������:Cl2>Fe3+>SO2 �Ľ��ۡ�II��ͬѧ���IJ���3��Һֻ��Fe3+����Fe2+����III��ͬѧ���ƣ���Һ�ж��п����ܽ��й�������������˲���5�м���SO42- ���п������ܽ������еĹ�����������SO2���ã����Բ���˵��������Fe3+>SO2 �����ѡI��III��
��5����Ҫ�����ϼͱ�װ��֤��������Ϊ��Cl2> Fe3+> I2�Ľ��ۣ������Ҫ�ڷ�Һ©���м��뺬��Fe2+ ��I-���Լ������Կ���ѡ��FeI2 ����Һ��֤������������Fe3+�� I2 ����Ҫ��������Ե��Լ�KSCN���л��ܼ���CCl4�����۲�ֲ����Һ���ϲ�dz��ɫ��죬�²����Ϻ�ɫ���������ȷ��
���㣺���⿼�����

�ɷ����Ʊ�FeCl2����Ҫ�������£�
����ͼ��ʾ�����Ʊ�FeCl3?6H2O 
��1�����в�������ĵ���ʽ�� ��
��2�������ӷ���ʽ��ʾ���̢���ϡ��������� ���ڸù�����Ҫ��������Һ�в������ᣬĿ���� ��
����FeCl3 ? 6H2O�Ƶø���FeCl2�Ĺ������£�
������ʢ��FeCl3 ? 6H2O�������м���SOCl2�����ȣ������ˮFeCl3
��������ˮFeCl3���ڷ�Ӧ���У�ͨ����в���������һ��ʱ�����ȣ�����FeCl2
�����ռ�FeCl2�����汸��
��3�� SOCl2��ˮ�Ӵ���Ѹ�ٲ���������SO2�����ȷֽ�FeCl3 ? 6H2O���ܵõ���ˮFeCl3�������袡�пɵõ���ˮFeCl3����ϱ�Ҫ��ѧ����ʽ���͵õ���ˮFeCl3��ԭ�� ��
��4�����̢��в���FeCl2�Ļ�ѧ����ʽ�� ��
��FeCl2�İ�װ�����а�ȫע����������������£�
| Ʒ �� | �Ȼ����� |
| �������� | ��ɫ���������ױ�ɻ�ɫ������ˮ���и�ʴ�ԡ��� |
| ע������ | ����Ӵ���������ȣ�����ϩ����Ͱ��װ���������� |
��5������˵����ȷ���� ��
a���ܱձ��桢Զ���Դ
b��������ǿ��������ͬ��š�����
c������������������װ��Ҫ�þ���ϩ����Ͱ��װ
��6��FeCl2�ڿ��������ȿ������Ȼ������������ȣ���Ӧ�Ļ�ѧ����ʽ�� ��
���ǻ��õļ����Ԫ�أ��Ƽ��仯�������������������й㷺��Ӧ�á�
������м��㣺
��1���������ƣ�NaN3����ײ���ֽ�����ƺ͵������ʿ�Ӧ����������ȫ���ҡ���78�˵���������ȫ�ֽ⣬������״���µ���___________________L ��
��2����-�غϽ���ں˷�Ӧ���������Ƚ���Һ��5.05 g��-�غϽ�����200 mLˮ����0.075 mol������������Һ���������Ƶ����ʵ���Ũ��______________________������Һ������仯����
��3������������Һ�����������ˣ��õ��������Ƶ���Һ�������Һ��ͨ�������̼�������з�Ӧ�� 2NaAl(OH)4+CO2��2Al(OH)3��+Na2CO3+H2O����֪ͨ�������̼112 L����״���£������ɵ�Al(OH)3��Na2CO3�����ʵ���֮��Ϊ4:5���������Һ��ͨ��Ķ�����̼Ϊ224L����״���£����������ɵ� Al(OH)3��Na2CO3�����ʵ��������ֵ��
��4��Ϊ�ⶨij�������պ�������������������е�Ԫ�ص������������ֽ���ͬ��������ι���ֱ���뵽50.00mL��ͬŨ�ȵ�����������Һ�У���ˮԡ����������ȫ���ݳ�(���¶�����β��ֽ�)�������徭�������Ũ����������ȫ���ⶨŨ�������ӵ����������ֲⶨ������±���
| ������/g | 10.00 | 20.00 | 30.00 | 50.00 |
| Ũ�������ӵ�����/g | m | m | 1.29 | 0 |
�Իش�
����εijɷ�Ϊ_______________________________��
������е�Ԫ�ص���������Ϊ��_______________________________(����ʽ���㣩��

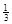 Na3AlH6 (s)+
Na3AlH6 (s)+ 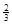 Al (s) + H2(g) ��H��+ 37 kJ��mol��1
Al (s) + H2(g) ��H��+ 37 kJ��mol��1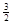 H2(g) ��H��+ 70.5 kJ��mol��1
H2(g) ��H��+ 70.5 kJ��mol��1