题目内容
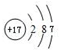
7.A、B、C、D、E、F是原子序数由小到大排列的六种短周期主族元素,其中A、B、C、E的原子序数之和为32.A是周期表中原子半径最小的元素,B、C左右相邻,A与D、C与E分别位于同族.(1)F元素原子结构示意图为:
 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7.(2)A与C按原子数目1:1组成的化合物的电子式为
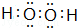 .
.(3)用电子式表示D和F组成化合物的形成过程:
 .
.(4)A、B、C、E四种元素中的三种能组成一种常见的强酸.该酸的稀溶液能与铜反应,其中起酸性作用的酸占消耗酸总物质的量的百分比是75%.
(5)由A、B、C、E四种元素组成一种离子化合物X.已知1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下X与NaOH浓溶液反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(6)A、B、C、E和Fe五种元素组成化学式式量为392的化合物Y,1mol Y含有6mol结晶水.对化合物Y进行如下实验:
a.取Y的溶液加入过量浓NaOH溶液并加热,产生无色有刺激性气味的气体和白色沉淀.该白色沉淀迅速变为灰绿色,最终变为红褐色.
b.另取Y的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
①Y的化学式为(NH4)2SO4•FeSO4•6H2O;
②写出Y与足量Ba(OH)2溶液反应的离子方程式:2NH4++Fe2++2SO42-+2Ba2++4OH-═Fe(OH)2↓+2BaSO4↓+2NH3↑+2H2O.
分析 A、B、C、D、E、F是原子序数由小到大排列的六种短周期主族元素,其中A、B、C、E的原子序数之和为32,A是元素周期表中原子半径最小的元素,则A为H元素;B、C左右相邻,C、E位于同主族,设B的原子序数为x,则C原子序数为x+1,E原子序数为x+1+8,故1+x+x+1+x+1+8=32,解得x=7,故B为N元素,C为O元素,E为S元素,则F为Cl;A与D同主族,结合原子序数之和可知,D为Na元素;
(1)F为Cl元素,原子核外有3个电子层,各层电子数为2、8、7;最高价正价为+7;
(2)A与C按原子数目1:1组成的化合物H2O2;
(3)D和F组成化合物为NaCl,由钠离子与氯离子构成,用Na原子、Cl原子电子式表示其形成过程;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,则该酸为硝酸,稀硝酸与Cu反应方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(5)由H、N、O、S四种元素组成的一种离子化合物X,1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵,铵根离子与氢氧根离子反应生成氨气;
(6)由H、N、O、S和Fe五种元素组成的式量为392的化合物Y,Y的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体,过一段时间白色沉淀变为灰绿色,最终变为红褐色,可知Y中含有Fe2+、NH4+,另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol B中含有6mol结晶水,令Y的化学式为x(NH4)2SO4•yFeSO4•6H2O,结合其相对分子质量确定.
解答 解:A、B、C、D、E、F是原子序数由小到大排列的六种短周期主族元素,其中A、B、C、E的原子序数之和为32,A是元素周期表中原子半径最小的元素,则A为H元素;B、C左右相邻,C、E位于同主族,设B的原子序数为x,则C原子序数为x+1,E原子序数为x+1+8,故1+x+x+1+x+1+8=32,解得x=7,故B为N元素,C为O元素,E为S元素,则F为Cl;A与D同主族,结合原子序数可知,则D为Na元素;
(1)F为Cl元素,原子核外有3个电子层,各层电子数为2、8、7,原子结构示意图为 ;最高价正价为+7,最高价氧化物化学式为:Cl2O7,
;最高价正价为+7,最高价氧化物化学式为:Cl2O7,
故答案为: ;Cl2O7;
;Cl2O7;
(2)A与C按原子数目1:1组成的化合物H2O2,电子式为: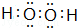 ,
,
故答案为: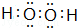 ;
;
(3)D和F组成化合物为NaCl,由钠离子与氯离子构成,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,则该酸为硝酸,稀硝酸与Cu反应方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,其中起酸性作用的酸占消耗酸总物质的量的百分比是$\frac{6}{8}$×100%=75%,
故答案为:75%;
(5)由H、N、O、S四种元素组成的一种离子化合物X,1molX能与足量NaOH浓溶液反应生成标准状况下44.8L气体,说明该物质阳离子为NH4+,且1molA中含有2molNH4+,则A为硫酸铵或亚硫酸铵,铵根离子与氢氧根离子反应生成氨气,反应离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(6)①由H、N、O、S和Fe五种元素组成的式量为392的化合物Y,Y的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色,可知Y中含有Fe2+、NH4+;
另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B中含有硫酸根离子,又1mol B中含有6mol结晶水,令Y的化学式为x(NH4)2SO4•yFeSO4•6H2O,则:(96+36)x+(96+56)y+108=392,则x=y=1,故Y化学式为:(NH4)2SO4•FeSO4•6H2O,
②与足量Ba(OH)2溶液反应的离子方程式为:2NH4++Fe2++2SO42-+2Ba2++4OH-═Fe(OH)2↓+2BaSO4↓+2NH3↑+2H2O,
故答案为:(NH4)2SO4•FeSO4•6H2O;2NH4++Fe2++2SO42-+2Ba2++4OH-═Fe(OH)2↓+2BaSO4↓+2NH3↑+2H2O.
点评 本题考查位置结构性质的应用、无机物推断等,明确B、C、E的位置及原子序数的关系来推断元素是关键,需要学生熟练掌握元素化合物性质,难度较大.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案| A. | 乙醛 | B. | 甲醛 | C. | 丙醛 | D. | 丁醛 |
| A. | $\frac{1.225a}{35.5}$×100% | B. | $\frac{122.5(1-\frac{74.5×a%}{35.5})}{48}$×100% | ||
| C. | $\frac{1.225a}{35.5}$% | D. | 无法计算 |
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 0.1mol甲基中含有的电子数为NA | |
| C. | 2.8 g乙烯和聚乙烯的混合物中所含碳原子数为0.2NA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
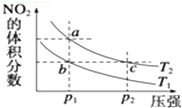 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的( )| A. | a、c两点的反应速率:a>c | |
| B. | a、c两点气体的颜色:a深,c浅 | |
| C. | b、c两点的平衡常数:b<c | |
| D. | a、c两点气体的平均相对分子质量:a>c |
| A. | CH2=CH2 | B. | C6H5OH | C. | 裂化汽油 | D. | 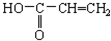 |
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 过滤 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 振荡、分液 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
 .
. ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为 ,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).