题目内容
15.某氯酸钾样品中含有杂质氯化钾,其中氯元素质量分数为a%,则此氯酸钾样品的纯度为( )| A. | $\frac{1.225a}{35.5}$×100% | B. | $\frac{122.5(1-\frac{74.5×a%}{35.5})}{48}$×100% | ||
| C. | $\frac{1.225a}{35.5}$% | D. | 无法计算 |
分析 根据KClO3、KCl的化学式,可以根据氯元素的质量分数求得钾元素的质量分数,从而求得氧元素的质量分数,根据氧元素的质量分数,就可以求得氯酸钾的质量分数.
解答 解:氯元素质量百分含量为a%,所以钾元素的质量分数为$\frac{39}{35.5}$×a%=$\frac{78a}{71}$%,则混合物中氧元素的质量分数为1-$\frac{78a}{71}$%-a%=1-$\frac{149a}{71}$%,因此氯酸钾药品的纯度为$\frac{39+35.5+16×3}{16×3}×(1-\frac{149a}{71}%)$=$\frac{122.5(1-\frac{74.5×a%}{35.5})}{48}$×100%,
故选B.
点评 本题考查混合物中元素的质量分数,根据混合物的化学式以及灵活运用质量分数公式是正确解答本题的关键,题目难度中等.

练习册系列答案
相关题目
5.在标准状况下,相同质量的下列气体中体积最大的是( )
| A. | NO | B. | CO2 | C. | N2 | D. | O2 |
6.一定温度下(T1<T2),在三个体积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)═CH3OH(g)
下列说法正确的是( )
| 容器 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CO | H2 | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0.18 |
| Ⅱ | T1 | 0.4 | 0.8 | |
| Ⅲ | T2 | 0.2 | 0.4 | 0.16 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达平衡时,容器Ⅰ中CH3OH(g)的体积分数比容器Ⅱ中的大 | |
| C. | 采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO的转化率 | |
| D. | 若起始时向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,则反应将向正反应方向进行 |
10.如图是CO2电催化还原为CH4的工作原理示意图.正确的是( )
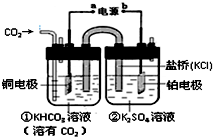

| A. | 该装置为原电池,其中a为正极 | |
| B. | 铜电极的电极反应式为:CO2+8H++8e-$?_{加热}^{催化剂}$CH4+2H2O | |
| C. | 反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 | |
| D. | 一段时间后,②池中溶液的pH一定下降 |
20.在可逆反应中,改变下列条件一定能加快反应速率的是( )
①增大反应物浓度 ②升高温度 ③增大压强 ④使用催化剂 ⑤增大表面积.
①增大反应物浓度 ②升高温度 ③增大压强 ④使用催化剂 ⑤增大表面积.
| A. | 全部 | B. | ①② | C. | ①②③ | D. | ①②③④ |
4.下列气体不能用浓硫酸作干燥剂的是( )
①HCl ②NH3 ③Cl2 ④H2 ⑤SO2?⑥HI.
①HCl ②NH3 ③Cl2 ④H2 ⑤SO2?⑥HI.
| A. | ①②⑥ | B. | ②⑤⑥ | C. | ①⑥ | D. | ②⑥ |
5.下列化学用语表示正确的是( )
| A. | 乙酸的最简式:CH2O | B. | Cl-的结构示意图: | ||
| C. | 甲醛的电子式: | D. | 对硝基甲苯的结构简式: |
 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为
 .
. ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7. .
. .
.