题目内容
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
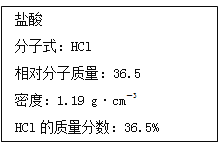
(1)该浓盐酸中HCl的物质的量浓度为______ mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸加蒸馏水稀释至500 mL,得到物质的量浓度为0.400 mol·L-1的稀盐酸。该学生需要量取________ mL上述浓盐酸进行配制。
(4)假设该同学用0.400 mol·L-1的盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
【答案】11.9B、D16.825
【解析】
(1)根据公式c=![]() ,带入数值可得盐酸的浓度c=1.19×1000×36.5%/36.5=11.9mol/L,故该盐酸的浓度是11.9mol/L;综上所述,本题答案是:11.9。
,带入数值可得盐酸的浓度c=1.19×1000×36.5%/36.5=11.9mol/L,故该盐酸的浓度是11.9mol/L;综上所述,本题答案是:11.9。
(2)A、溶液中HCl的物质的量与溶液体积有关,故A不选;
B、溶液具有均一性,溶液的浓度与溶液的体积无关,故B选;
C、溶液中Cl-的数目与溶液的体积有关,故C不选;
D、给定的溶液,其密度不变,所以密度与溶液的体积无关,故D选;
综上所述,本题选BD。
(3)根据稀释溶液前后,溶质的物质的量不变,即:c1V1=c2V2,设需要浓盐酸的体积V1L,则11.9mol/L×V1=0.400mol/L×0.5L,所以V1=0.0168L=16.8mL;综上所述,本题答案是:16.8。
(4)根据反应:NaOH+HCl=NaCl+H2O可知,n(HCl)=n(NaOH)=0.4/40=0.01mol,则:V(HCl)=0.01/0.400=0.025L=25mL;综上所述,本题答案是:25。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】Ⅰ.汽车尾气排放的NOX和CO污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g)△H=+180.5 kJ·mol-1
2NO(g)△H=+180.5 kJ·mol-1
回答下列问题:
(1)CO的燃烧热为___________,若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___________kJ。
(2)为了模拟反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)___________。
②能说明上述反应达到平衡状态的是___________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(3)在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。

该反应为___________反应(填“吸热”或“放热”),已知图中a点对应温度下,NO2的起始压强P0为120kPa,计算该温度下反应的平衡常数Kp的值为___________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.N2H4-O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
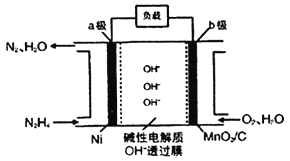
N2H4的电子式为___________;a极的电极反应方程式为___________;