题目内容
【题目】已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为 _______________。
(2)关于B2A2的下列说法中正确的是 _________________。
A. B2A2中的所有原子都满足8电子结构
B. 每个B2A2分子中σ键和π键数目比为1:1
C. B2A2是由极性键和非极性键形成的非极性分子
D. B2A2分子中的B-A键属于s —spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是 ___________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因 _____________________________。
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有__________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相等, N的结构式为__________。
(6)E的氢化物的价层电子对互斥理论模型为 _______,E 原子的杂化方式为 ________杂化。
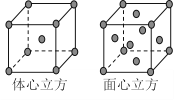
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为__________________。
【答案】 3d64s2 CD 直线形 C元素原子的最外层电子的p轨道处于半充满状态,能量低,较稳定,失去第一个电子需要的能量较B、D多 极性键、非极性键 ![]() 四面体形 sp3 2b3:a3 【答题空10】3:2
四面体形 sp3 2b3:a3 【答题空10】3:2
【解析】已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,A为氢元素,B原子最外层电子数是内层电子数的2倍,B有2个电子层,最外层电子数为4,故B为碳元素,D、E为同主族元素,且E的原子序数为D的2倍,D为氧元素,E为硫元素,故C为氮元素,F元素在地壳中含量位于金属元素的第二位,F为Fe元素。
(1)Fe元素是26号元素,价层电子排布式为3d64s2;(2)B2A2为C2H2,A、分子中H原子不满足8电子结构,选项A错误;B、含有2个C-H键、1个C≡C三键,单键为σ键,三键中含有1个σ键、2个π键,σ键与π键之比为3:2,选项B错误;C、C-H为极性键,C≡C三键是非极性键,为对称结构,属于非极性分子,选项C正确;D、分子中C原子采取sp杂化,故C-H键为s-spσ键,选项D正确;答案选CD;(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则为CO2与N2O,CO2是直线型;(4)N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定,失去第一的电子需要的能量比C、O多;(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,X为H2O,Y为H2O2,Y中含有O-H键,是极性键,含有O-O键为非极性键,A与C组成的两种化合物M和N所含的电子数分别与X、Y相,则M为NH3,N为N2H4,结构式为![]() ;(6)E的氢化物为H2S,S原子成2个S-H键,含有2对孤电子对,价层电子对为4,价层电子对互斥理论模型为四面体型,S原子的杂化方式为SP3杂化;(7)面心立方晶胞边长为acm,体积V=a3,含有Fe原子数目为8×
;(6)E的氢化物为H2S,S原子成2个S-H键,含有2对孤电子对,价层电子对为4,价层电子对互斥理论模型为四面体型,S原子的杂化方式为SP3杂化;(7)面心立方晶胞边长为acm,体积V=a3,含有Fe原子数目为8×![]() +6×
+6×![]() =4,故a3ρ(面心)=4×
=4,故a3ρ(面心)=4×![]() ,体心立方晶胞边长为bcm,体积V=b3,含有Fe原子数目为8×
,体心立方晶胞边长为bcm,体积V=b3,含有Fe原子数目为8×![]() +1=2,故b3ρ(体心)=2×
+1=2,故b3ρ(体心)=2×![]() ,故ρ(面心):ρ(体心)=2b3:a3。面心立方晶胞中每个Fe原子周围有12个Fe原子,体心立方晶胞中每个Fe原子周围有8个Fe原子,故Fe原子配位数之比为12:8=3:2。
,故ρ(面心):ρ(体心)=2b3:a3。面心立方晶胞中每个Fe原子周围有12个Fe原子,体心立方晶胞中每个Fe原子周围有8个Fe原子,故Fe原子配位数之比为12:8=3:2。