题目内容
【题目】铁及其化合物有着广泛的用途。请回答:
(1)高炉炼铁是目前普遍采用的冶炼铁的方法。已知:
FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=a kJ·mol-1
Fe(s)+CO2(g) △H=a kJ·mol-1
Fe2O3(s)+CO(g)![]() 2FeO(s)+CO2 △H=b kJ·mol-1
2FeO(s)+CO2 △H=b kJ·mol-1
工业上用铁红冶炼铁的热化学方程式为_________________________________。
(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化。
①该反应的离子方程式为_________________________________。
②T ℃时,向0.5mol·L-1 Fe(NO3)3溶液中加入足量Ag,溶液中c(Ag+)与反应时间(t)的关系如图1所示(溶液体积变化忽略不计)。
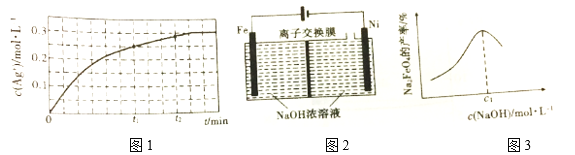
t1时,溶液中c(Fe3+)=__________;t1、t2时,逆反应速率v逆1______v逆2(填“>”“<”或“=”)理由为_________________________________。
③T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,再加入6.0g Ag,一段时间后,Ag的质量________(填“增大”“减小”或“不变”)。
④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,理由为__________。
(3)Na2FeO4是重要的水处理剂,在强碱性介质中稳定,可用图2所示装置制备。已知:电解时,碱的浓度过高,阳极区产生红色物质。
①电解时,阴极附近溶液的碱性__________(填“增大”“减小”或“不变”)。
②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为_________________________________。
【答案】 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 Fe3++Ag
2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 Fe3++Ag![]() Fe2++Ag+ 0.25mol·L-1 < t2时c(Ag+)更大,逆反应速率加快 减小 Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag
Fe2++Ag+ 0.25mol·L-1 < t2时c(Ag+)更大,逆反应速率加快 减小 Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag![]() Fe2++Ag+ 平衡正向移动 增大 c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生
Fe2++Ag+ 平衡正向移动 增大 c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生
【解析】(1)①FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H=a kJ·mol-1,②Fe2O3(s)+CO(g)
Fe(s)+CO2(g) △H=a kJ·mol-1,②Fe2O3(s)+CO(g)![]() 2FeO(s)+CO2 △H=b kJ·mol-1,由盖斯定律,①×2+②,得工业上用铁红冶炼铁的热化学方程式为Fe2O3(s)+3CO(g)
2FeO(s)+CO2 △H=b kJ·mol-1,由盖斯定律,①×2+②,得工业上用铁红冶炼铁的热化学方程式为Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 。(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化,Fe3+将银氧化。①该反应的离子方程式为Fe3++Ag
2Fe(s)+3CO2(g) △H=(2a+b) kJ·mol-1 。(2)Fe(NO3)3溶液可用于刻蚀银器,该过程中存在Fe2+和Fe3+之间的转化,Fe3+将银氧化。①该反应的离子方程式为Fe3++Ag![]() Fe2++Ag+ 。②t1时,银离子浓度0.25mol·L-1 ,反应的铁离子为0.25mol·L-1 ,溶液中c(Fe3+)=0.25mol·L-1;t1、t2时,逆反应速率v逆1<v逆2,理由为t2时c(Ag+)更大,逆反应速率加快。③由②平衡时银离子浓度0.3mol·L-1 ,反应的铁离子为0.3mol·L-1 ,溶液中c(Fe3+)=0.2mol·L-1;平衡常数K=0.32/0.2=0.45,现T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,Qc=
Fe2++Ag+ 。②t1时,银离子浓度0.25mol·L-1 ,反应的铁离子为0.25mol·L-1 ,溶液中c(Fe3+)=0.25mol·L-1;t1、t2时,逆反应速率v逆1<v逆2,理由为t2时c(Ag+)更大,逆反应速率加快。③由②平衡时银离子浓度0.3mol·L-1 ,反应的铁离子为0.3mol·L-1 ,溶液中c(Fe3+)=0.2mol·L-1;平衡常数K=0.32/0.2=0.45,现T ℃时,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,Qc=![]() =0.16<k,平衡正向移动,再加入6.0g Ag,一段时间后,Ag的质量减小。④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,因为溶液的组成不同,Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag
=0.16<k,平衡正向移动,再加入6.0g Ag,一段时间后,Ag的质量减小。④实验表明,相同条件下,FeCl3溶液比Fe(NO3)3溶液更容易刻蚀银,因为溶液的组成不同,Ag+ 与Cl- 生成AgCl沉淀,c(Ag+)减小,Fe3++Ag![]() Fe2++Ag+ 平衡正向移动。(3)①阳极是Fe失去电子,碱性条件下生成FeO42-,阳极电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,阴极:2H2O+2e-=2OH-+H2,阴极室得到A溶液为NaOH溶液,可以循环利用,电解时,阴极附近溶液的碱性增大。②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为:c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生。
Fe2++Ag+ 平衡正向移动。(3)①阳极是Fe失去电子,碱性条件下生成FeO42-,阳极电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,阴极:2H2O+2e-=2OH-+H2,阴极室得到A溶液为NaOH溶液,可以循环利用,电解时,阴极附近溶液的碱性增大。②电解时,Na2FeO4的产率与起始加入的c(NaOH)的关系如图3所示。c(NaOH)=c1 mol·L-1时,Na2FeO4产率最大的原因为:c(NaOH)<c1 mol·L-1时,Na2FeO4稳定性差且反应慢;c(NaOH)>c1 mol·L-1时,有副反应发生。
点晴:难点(2)③判断反应进行的方向,用溶液的浓度商与K值进行比较,要通过读图求出K,易错点,求Qc,将体积均为100 mL的0.5mol·L-1 Fe(NO3)3溶液、0.4mol·L-1 Fe(NO3)2溶液、0.6mol·L-1 AgN03溶液混合后,Qc=![]() =0.16<K,计算式中的溶液的体积为原来的三分之一,易被忽略,0.6×0.4/0.5=0.45>k,导致错误。
=0.16<K,计算式中的溶液的体积为原来的三分之一,易被忽略,0.6×0.4/0.5=0.45>k,导致错误。

 阅读快车系列答案
阅读快车系列答案