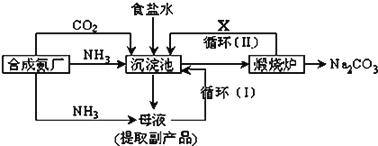
题目内容
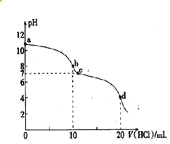
【题目】常温时,用0.1000mol/LNaOH溶液滴定25.00mL0.1000mol/L 某一元酸HX 溶液,滴定过程中pH变化曲线如图所示,下列说法不正确的是
A. 在A点:c (HX)>c(Na+)>c(X-) B. 在B点,溶液中c(H+)=c(OH-)
C. 0.05mol/L NaX 溶液的pH≈9.0 D. C 点溶液中存在的主要平衡是X-+ H2O![]() HX+OH-
HX+OH-
【答案】A
【解析】
A项,在滴定过程中溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(X-),在A点溶液呈酸性c(H+)![]() c(OH-),则A点c(Na+)
c(OH-),则A点c(Na+)![]() c(X-),错误;B项,由图知B点溶液pH=7.0,溶液呈中性,c(H+)=c(OH-),正确;C项,由图知,当加入25.00mL NaOH溶液时NaOH与HX恰好完全反应得到0.05mol/L的NaX溶液,由图知0.05mol/LNaX溶液的pH
c(X-),错误;B项,由图知B点溶液pH=7.0,溶液呈中性,c(H+)=c(OH-),正确;C项,由图知,当加入25.00mL NaOH溶液时NaOH与HX恰好完全反应得到0.05mol/L的NaX溶液,由图知0.05mol/LNaX溶液的pH![]() 9.0,正确;D项,C点加入25.00mLNaOH溶液,此时NaOH与HX恰好完全反应得到0.05mol/L的NaX溶液,NaX溶液的pH
9.0,正确;D项,C点加入25.00mLNaOH溶液,此时NaOH与HX恰好完全反应得到0.05mol/L的NaX溶液,NaX溶液的pH![]() 7,则HX为一元弱酸,此时存在的主要平衡是X-的水解平衡,水解离子方程式为X-+H2O
7,则HX为一元弱酸,此时存在的主要平衡是X-的水解平衡,水解离子方程式为X-+H2O![]() HX+OH-,正确;答案选A。
HX+OH-,正确;答案选A。

练习册系列答案
相关题目
【题目】下列选项中能发生化学反应,并且甲组为取代反应,乙组为加成反应的是
选项 | 甲 | 乙 |
A | 苯与溴水 | 乙烯与水制乙醇 |
B | 乙酸乙酯水解 | 苯与氢气 |
C | 乙醇的催化氧化 | 乙酸和乙醇的酯化反应 |
D | 乙烯与溴的四氯化碳溶液 | 甲烷与氯气 |
A.AB.BC.CD.D