题目内容
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
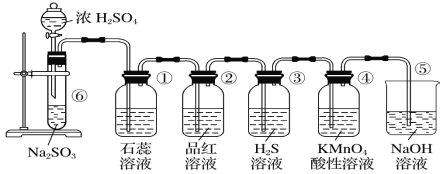
(1)在⑥中发生反应的化学方程式为________。
(2)①中的实验现象为石蕊溶液__________,证明SO2的水溶液显_______性。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
【答案】Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑ + H2O 变红, 酸 褪色 漂白 有黄色沉淀生成 氧化性 酸性高锰酸钾褪色 还原性
【解析】
(1)亚硫酸钠与浓硫酸反应生成二氧化硫、硫酸钠和水;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫;
(5)二氧化硫具有还原性,能够被酸性高锰酸钾溶液氧化。
(1)①中为亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑。
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:变红;酸性。
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,故答案为:褪色;漂白。
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H2O,故答案为:有黄色沉淀生成;氧化。
(5)二氧化硫具有还原性,能够被酸性高锰酸钾容易氧化,使酸性高锰酸钾溶液褪色,故答案为:酸性高锰酸钾褪色;还原性。

 学习实践园地系列答案
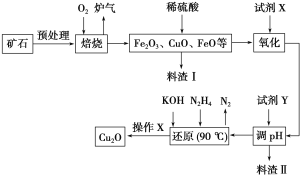
学习实践园地系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
【题目】I. 合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
II.(1)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K=_____(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
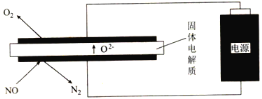
阴极的电极反应式为___________________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________。