题目内容
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
| A.-1 780 kJ/mol | B.-1 220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
B
解析试题分析:280+3*160-330*6=-1220,所以B正确。
考点: 能量。

已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496 kJ,水蒸气1molH-O键形成时放出热量463 kJ,则氢气中1molH-H键断裂时吸收热量为
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
下列说法正确的是
| A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol |
| B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为 —285.8kJ/mol |
| C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D.在稀溶液中:H+(aq) + OH--(aq) ="==" H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
信息、材料、能源被称为新科技革命的“三大支柱”。下列观点或做法错误的是
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机 |
| C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅 |
| D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机 |
下列有关中和热的说法正确的是( )
| A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol |
| B.准确测量中和热的实验过程中,至少需测定温度4次 |
| C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
| D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ; ΔH=-1 367.0 kJ·mol-1(燃烧热) |
| B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l); ΔH=-57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)=SO2(g); ΔH=-269.8 kJ·mol-1(反应热) |
| D.2NO2=O2+2NO; ΔH=+116.2 kJ·mol-1(反应热) |
已知热化学方程式(Q1、Q2均为正值):
C(s)+ O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g) ΔH=-Q2 kJ·mol-1,
O2(g) =CO(g) ΔH=-Q1 kJ·mol-1,C(s)+O2(g) =CO2(g) ΔH=-Q2 kJ·mol-1,
有关上述反应的叙述错误的是
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ的热量 |
| D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量 |
根据下列热化学方程式:
(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
(2)H2(g)+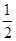 O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ·mol-1
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
| A.ΔH=+244.1 kJ·mol-1 |
| B.ΔH=-488.3 kJ·mol-1 |
| C.ΔH=-996.6 kJ·mol-1 |
| D.ΔH=+996.6 kJ·mol-1 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 | C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |