题目内容
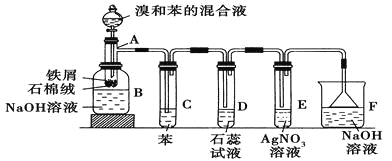
【题目】如图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
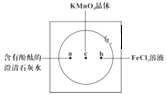
(1)浓盐酸在反应中表现出来的性质是______ (填写编号),氧化剂与还原剂物质的量之比为______ ,氧化产物为______ 。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是___________________________,工业上用此原理制取漂白粉。
(4)b处离子方程式是________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为:称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:___________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式: ____MnO4-+___H2C2O4+____=___Mn2++___CO2↑+____
③石灰石中CaCO3的百分含量:_______
【答案】② 1:5 Cl2 0.2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Fe2++Cl2=2Fe3++2Cl CaC2O4+2H+=Ca2++H2C2O4 2 5 6 2 10 8H2O 80%
【解析】
(1)根据反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O可得,反应中生成KCl、MnCl2,盐酸显示酸性,生成Cl2,氯元素化合价升高,做还原剂,氧化产物为Cl2,盐酸显示还原性。KMnO4中Mn化合价降低,做氧化剂。氧化剂与还原剂物质的量之比=2:10=1:5;
答案为:②;1:5;Cl2;
(2)根据反应方程式,生成5 mol Cl2,转移10 mol电子,现产生0.1 mol Cl2,转移电子0.2 mol电子;
答案为:0.2
(3)a处Cl2和Ca(OH)2反应,化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(4)b处Cl2和氯化亚铁反应,可氧化亚铁离子,溶液由浅绿色变为黄色,离子方程式:2Fe2++Cl2=2Fe3++2Cl;
答案为:2Fe2++Cl2=2Fe3++2Cl;
(5)①草酸钙与盐酸发生复分解反应生成草酸和氯化钙,反应的离子方程式:CaC2O4+2H+=Ca2++H2C2O4;
故答案为:CaC2O4+2H+=Ca2++H2C2O4;
②根据元素守恒知,生成物中还含有水,该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,所以MnO4、H2C2O4的计量数分别是2、5,再结合原子守恒配平方程式为2MnO4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2;5;6;2;10;8;
③依据题意可知:CaCO3CaC2O4H2C2O4![]() MnO4,
MnO4,
则:CaCO3![]() MnO4,
MnO4,
100g 0.4mol
m(CaCO3) 0.016mo/L×0.025L
解得:m(CaCO3)=0.1g,
则碳酸钙的含量为:![]() =80%;
=80%;
故答案为:80%。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
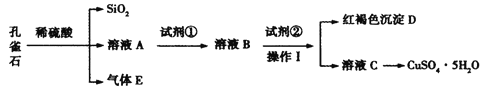
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
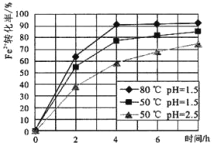
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度