题目内容
【题目】(一)某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=_______、T1=______/span>;通过实验______(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=_____。
(3)忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=____mol·L-1·min-1。
(二)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2):
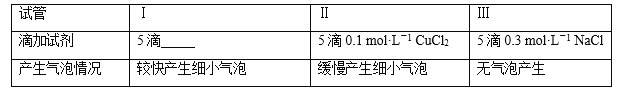
(1)上表试管Ⅰ中应添加的试剂为5滴____________。
(2)结论是_________,实验Ⅲ的目的是__________。
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 浓度 1 293 BC 3 0.05mol·L-1· min-1 0.1 mol·L-1 FeCl3溶液 Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好 对比实验,证明Cl-对H2O2的分解没有催化作用
【解析】
(一) (1)KMnO4与草酸在酸性条件发生氧化还原反应,产生Mn2+、CO2、H2O,根据电子守恒、电荷守恒及原子守恒,书写反应的离子方程式;
(2)A、B应控制温度相同,探究浓度对反应速率的影响,B、C温度不同可探究温度对反应速率的影响,研究某种因素对反应速率的影响时,需要保证气体条件相同;
(3)结合v=![]() 计算z反应速率;
计算z反应速率;
(二)要对比Fe3+和Cu2+对H2O2分解反应的催化效果,试管II是CuCl2,则试管I应该为FeCl3溶液,还必须排除溶液中的阴离子是否有催化作用,试管Ⅲ就很好的解决了这个问题。
(一) (1)KMnO4与草酸在酸性条件发生氧化还原反应,产生Mn2+、CO2、H2O,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)实验A、B,滴加H2C2O4溶液的体积不等,故实验A、B可探究出H2C2O4浓度的改变对反应速率的影响;据实验A可知,保证溶液的总体积为6mL,B中H2C2O4溶液3mL,故需加水的体积V(H2O)=6mL-2mL-3mL=1mL;
A、B研究浓度对化学反应速率的影响,需要温度相同,故T1=293;
B、C温度不同,要探究出温度变化对化学反应速率的影响,其余条件相同,则V2=6mL-2mL-1mL=3mL;
(3)根据实验B中数据可知,高锰酸钾完全反应需要的时间为8s,高锰酸钾的物质的量n(KMnO4)=0.02mol/L×0.002L=0.00004mol,混合后溶液中高锰酸钾的浓度c(KMnO4)=![]() =
=![]() ×10-3mol/L,则用KMnO4的浓度变化表示的反应速率v(KMnO4)=
×10-3mol/L,则用KMnO4的浓度变化表示的反应速率v(KMnO4)=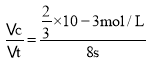 =8.3×10-4mol/(Ls)= 0.05mol/(L· min);
=8.3×10-4mol/(Ls)= 0.05mol/(L· min);
(二)试管Ⅰ、试管Ⅱ是为验证Fe3+和Cu2+对H2O2分解反应的催化效果,所用试剂的浓度、用量要完全一样,试管Ⅱ是是CuCl2,则试管I应该为FeCl3溶液,是5滴FeCl3溶液,试管Ⅲ无气泡产生,试管Ⅲ是一个对比实验,说明Cl-对H2O2的分解没有催化作用,试管I产生气泡快,多,试管II产生的气泡少,慢,从而得到Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的结论,证明Cl-对H2O2的分解没有催化作用。

【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
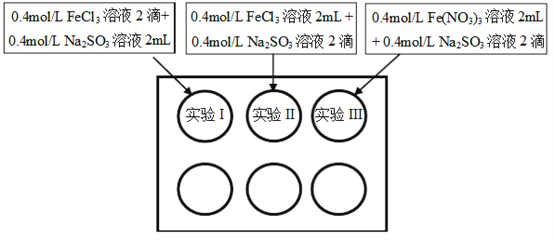
小组记录的实验现象如下表所示:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/L FeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是__________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是___________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV:分别取少量5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。根据实验IV的现象,结合化学用语解释红褐色变浅的原因是___________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl- 可以加快Fe3+与SO32-的氧化还原反应;
②___________;
③NO3- 在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mL pH=1.0的0.4mol/L Fe(NO3)3溶液中溶解约___________固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mL pH=1.0的稀硝酸中溶解约0.19g NaNO3固体,再加入2滴0.4mol/L Na2SO3溶液。向其中滴入少量BaCl2溶液 | _____________ |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,以下结果或推论合理的是___________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2 mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验I的上层清液中是否存在SO42-
