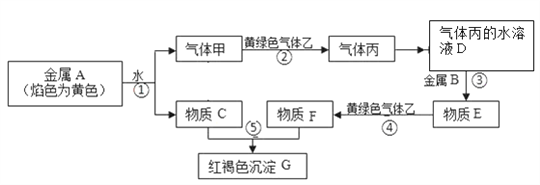
题目内容
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )

A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
【答案】D
【解析】
A.a点为0.01 mol·L-1的HA溶液,此时溶液中存在HA和H2O的电离平衡,故A错误;
B.b点为在20mL0.01 mol·L-1的HA溶液中滴加10mL0.01 mol·L-1的NaOH溶液,此时溶液中NaH和HA等物质的量混合,溶液pH<7,说明HA的电离程度大于A-的水解程度,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故B错误;
C.d点为滴加20mLNaOH溶液,此时恰好完全中和生成NaA,溶液中存在的电荷守恒式为c(OH-)+c(A-)=c(H+)+c(Na+),物料守恒式为c(Na+)=c(A-)+c(HA),则c(OH-)-c(H+)=c(HA)<c(A-),故C错误;
D.a点为HA溶液,b点是HA和NaA等浓度的混合溶液,c点是NaA和少量HA的混合液且溶液pH=7,d点是NaA的溶液,酸、碱溶液都抑制了水的电离,NaA促进水的电离,且所含NaA的浓度越大,溶液中水的电离程度越大,则a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d,故D正确;
故答案为D。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案【题目】根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
溶液 | 现象 | 结论 | |
A | 含HCl,BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2是酸性氧化物 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有还原性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
A.AB.BC.CD.D