题目内容
8.已知在298K时,有如下两个热化学方程式:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
现有0.2mol碳粉和H2的混合物,在O2中燃烧生成CO2(g)和H2O(g),共放出63.53kJ热量,则化合物中碳粉和H2的物质的量之比是( )
| A. | 1:2 | B. | 2:3 | C. | 3:2 | D. | 1:1 |
分析 物质放出的热量数值与物质的物质的量成正比,依据C、H2燃烧的热化学方程式分别计算出各自反应放出的热量据此解答.
解答 解:设0.2mol的碳粉和氢气中碳的物质的量为xmol,氢气的物质的量为ymol,依据C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,xmol碳燃烧放出的热量为393.5xkJ;依据2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1现,ymol氢气燃烧放出的热量为$\frac{483.6}{2}$×yKJ,由题意得:
393.5xkJ+$\frac{483.6}{2}$×yKJ=63.53kJ,
x+y=0.3mol,
解得:x=0.1mol,y=0.1mol 所以混合物中C与H2的物质的量之比为0.1mol:0.1mol=1:1,
故选D.
点评 本题考查有关反应热的计算,明确热化学反应方程式中物质的量与热量的关系即可解答,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
18.现有5种微粒,它们分别是1940X、1840Y、1940Z+、2040R2+、2041M,则它们所属的元素种类有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
19.某一元脂肪羧酸1mol,可以与1mol溴发生加成反应,0.1mol该羧酸充分燃烧生成水1.7mol,则该羧酸的分子式是( )
| A. | C18H36O2 | B. | C16H34O2 | C. | C18H34O2 | D. | C16H30O2 |
16.下列说法正确的是( )
| A. | NA个H2SO4分子的总质量就是H2SO4的摩尔质量 | |
| B. | 将40 g烧碱溶于水得溶液甲,再向甲中通入1 mol HCl得溶液乙(假设过程中溶液体积不变),则在相同温度下,甲和乙的导电能力一样 | |
| C. | 1 L 0.1 mol/L HF溶液中含有的离子总数约为0.2 NA | |
| D. | 标况下22.4 L SO3溶解于水并稀释为1 L后,溶液中c(H+)=2 mol/L |
3.硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成.某校化学研究性学习小组运用类比学习的思想,并通过实验探究Na2S2O3的化学性质.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
实验结论:
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | a.溶液pH=8 | i.S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 | ii.S2O32一+2H+=S↓+SO2↑ +H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
13.下列实验现象描述中错误的是( )
| A. | 红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| B. | 将SO2气体通入澄清石灰水中,石灰水变浑浊,继续通入SO2,浑浊不消失 | |
| C. | 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 | |
| D. | 钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
20.将质量相等的铁片和铜片插入氯化钠溶液中,铜片与电源的正极相连,铁片与电源的负极相连,以I=1A的恒定电流强度进行电解,下列有关说法正确的是( )
| A. | 阳极上产生能够使湿润淀粉碘化钾试纸变蓝的气体 | |
| B. | 电解一段时间后,电解池的温度升高10℃,此时铁片上析出气体的速率加快 | |
| C. | 电解时钠离子向铜片电极方向移动 | |
| D. | 电解一段时间后溶液中会出现蓝色沉淀,总反应为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑ |
17.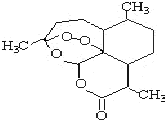 青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )
青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )
 青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )
青蒿素是一种由青蒿中分离得到的具有新型化学结构的抗疟药,结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H20O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 青蒿素与维生素一样是水溶性的 | |
| D. | 该化合物中含有过氧键,一定条件下有氧化性 |
