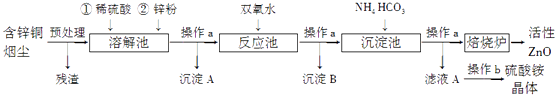
��Ŀ����
����Ŀ��ij�жԴ������м�⣬���ָ�����Ҫ��Ⱦ������������PM2.5��ֱ��С�ڵ���2.5��m�����������������Ҫ��ԴΪȼú��������β���ȣ����PM2.5��SO2��NO2��������о�������Ҫ���壮��ش��������⣺
��1����PM2.5��������������ˮ�����Ƴɴ�����������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� | K+ | Na+ | NH4+ | SO42�� | NO3�� | Cl�� |
Ũ��/molL��1 | 4��10��6 | 6��10��4 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
���ݱ��������ж�PM2.5�������Ϊ �� ������PHֵ= ��
��2��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϣ�
��֪��H2��g��+ ![]() O2��g��=H2O��g����H=��241.8kJ/mol��1
O2��g��=H2O��g����H=��241.8kJ/mol��1
C��s��+ ![]() O2��g��=CO��g����H=��110.5kJ/mol��1
O2��g��=CO��g����H=��110.5kJ/mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��
��ϴ�Ӻ�SO2���������������ʿ���Ϊϴ�Ӽ����� ��
a��Ca��OH��2 b��Na2CO3 c��CaCl2 d��NaHSO3
��3������β����NOx��CO�����ɼ�ת��
����֪����������NO�ķ�ӦΪ��N2��g��+O2��g��2NO��g����H��0��
��1mol������0.8mol N2��0.2mol O2 �� 1300��ʱ���ܱ������ڷ�Ӧ�ﵽƽ�⣮���NO�����ʵ���Ϊ8��10��4mol��������¶��µ�ƽ�ⳣ��K= �� ���������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ����
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO��g��=2C��s��+O2��g������֪�÷�Ӧ�ġ�H��0�������������ܷ�ʵ�ֵ����ݣ���
��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ���仯ѧ��Ӧ����ʽΪ ��
���𰸡�
��1�����ԣ�4
��2��C��s��+H2O��g��=H2��g��+CO��g����H=+131.3kJ/mol��ab
��3��4��10��6���¶����ߣ���Ӧ���ʼӿ죬ƽ�����ƣ���Ϊ�÷�Ӧ�ġ�H��0����S��0�������κ��¶��¾����Է����У�2CO+2N0 ![]() 2CO2+N2
2CO2+N2
���������⣺��1.�����ݵ���غ�ã�[H+]+[K+]+[Na+]+[NH4+]=2[SO42��]+[NO3��]+[Cl��]�����������ݴ���ã�[H+]=10��4 �� pH=��lg[H+]=4����Һ�����ԣ����Դ��ǣ����ԣ�4��
��2.����H2��g��+ ![]() O2��g��=H20 ��g����H=��241.8kJmol��1 ��
O2��g��=H20 ��g����H=��241.8kJmol��1 ��
C��s��+ ![]() O2��g��=CO ��g����H=��110.5kJmol��1��
O2��g��=CO ��g����H=��110.5kJmol��1��
���ø�˹���ɽ�����ʽ���Σ��ک��ٵ� C��s��+H2O��g��=H2��g��+CO��g����H=+131.3kJ/mol�����Դ��ǣ�C��s��+H2O��g��=H2��g��+CO��g����H=+131.3kJ/mol���ڶ����������������������Ծ��������������ͨ���ܹ���Ӧ��SO2+Ca��OH��2=CaSO3��+H2O����������ˮ��Һ������������Ҳ�ܹ���̼���Ʒ�Ӧ��SO2+Na2CO3=Na2SO3+CO2�����Կ���������������Һ��̼������Һ��ϴ�Ӽ��� �����������Ȼ�����Һ����Ӧ������������������Һ�е��ܽ�Ⱥ�С�����Բ������Ȼ��ƺ�������������Һ��ϴ��Һ�����Դ��ǣ�ab��
��3.�����跴Ӧ�����������aL
��������ã�
N2��g�� | + | O2��g�� | 2NO��g�� | ||
��ʼŨ�� |
|
| 0 | ||
ת��Ũ�� |
|
|
| ||
ƽ��Ũ�� |
|
|
|
���������ʵ�Ũ�ȴ������ʽ ��K= ![]() ��4��10��6 ��
��4��10��6 ��
�����¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ�����¶����ߣ���Ӧ���ʼӿ죬ƽ�����ƣ����Դ��ǣ�4��10��6���¶����ߣ���Ӧ���ʼӿ죬ƽ�����ƣ���2CO��g��=2C��s��+O2��g����һ����ֵ��С�ķ�Ӧ������S��0��ͬʱ����һ����H��O�����ԡ�H��T��Sһ������0�������κ������²����Է����У����Դ��ǣ���Ϊ�÷�Ӧ�ġ�H��0����S��0�������κ��¶��¾����Է����У���CO��NOx�ڴ���������Ӧ��2CO+2N0 ![]() 2CO2+N2 �� ���Դ��ǣ�2CO+2N0
2CO2+N2 �� ���Դ��ǣ�2CO+2N0 ![]() 2CO2+N2 ��
2CO2+N2 ��
�����㾫����������Ĺؼ��������⻯ѧƽ��ļ�������֪ʶ�����շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�