题目内容
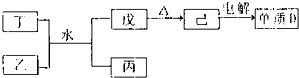
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示.请回答下列问题:
(1)B、C、D元素的非金属性由大到小的顺序为
(2)E的氢化物与其最高价氧化物对应水化物的钾盐共热能发生反应,生成一种气体单质.反应的化学方程式为
(3)C有多种氧化物,其中甲的相对分子质量最小,在一定条件下2L甲气体与0.5L氧气相混合,若该气体混合物被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来.若此置换反应生成3mol B的单质,则该反应在298K下的△H
(5)要证明与D同主族且相邻的元素的非金属性与E的非金属性强弱,正确、合理的实验操作及现象是
| B | C | D | ||
| A | E |
O>N>C
O>N>C
;(填元素符号)(2)E的氢化物与其最高价氧化物对应水化物的钾盐共热能发生反应,生成一种气体单质.反应的化学方程式为
8HCl+KClO4
KCl+4Cl2↑+4H2O
| ||
8HCl+KClO4
KCl+4Cl2↑+4H2O
;
| ||
(3)C有多种氧化物,其中甲的相对分子质量最小,在一定条件下2L甲气体与0.5L氧气相混合,若该气体混合物被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是
NaNO2
NaNO2
;(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来.若此置换反应生成3mol B的单质,则该反应在298K下的△H
-(4a-3b)KJ/mol
-(4a-3b)KJ/mol
(注:题中所设单质的为稳定单质).(5)要证明与D同主族且相邻的元素的非金属性与E的非金属性强弱,正确、合理的实验操作及现象是
将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成
将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成
.分析:由短周期主族元素A、B、C、D、E在元素周期表中的位置可知,B、C、D位于第二周期,则B为C,C为N,D为O,A为Al,E为Cl,
(1)同周期从左向右非金属性在增强;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl;
(3)甲的相对分子质量最小,则为NO,一定条件下2L甲气体与0.5L氧气相混合,生成NO2,且剩余NO,被碱液吸收发生氧化还原反应;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,则①Al(s)+
O2(g)=
Al2O3(s)△H=-aKJ/mol,②C(s)+O2(g)=CO2(g)△H=-bKJ/mol,
由盖斯定律可知,则①×4-②×3可得4Al(s)+3CO2(g)=3C(s)+2Al2O3(s);
(5)与D同主族且相邻的元素的非金属为S,利用单质之间的置换反应可证明S和Cl的非金属性强弱.
(1)同周期从左向右非金属性在增强;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl;
(3)甲的相对分子质量最小,则为NO,一定条件下2L甲气体与0.5L氧气相混合,生成NO2,且剩余NO,被碱液吸收发生氧化还原反应;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,则①Al(s)+
| 3 |
| 4 |
| 1 |
| 2 |
由盖斯定律可知,则①×4-②×3可得4Al(s)+3CO2(g)=3C(s)+2Al2O3(s);
(5)与D同主族且相邻的元素的非金属为S,利用单质之间的置换反应可证明S和Cl的非金属性强弱.
解答:解:由短周期主族元素A、B、C、D、E在元素周期表中的位置可知,B、C、D位于第二周期,则B为C,C为N,D为O,A为Al,E为Cl,
(1)同周期从左向右非金属性在增强,则非金属性为O>N>C,故答案为:O>N>C;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl,该反应为8HCl+KClO4
KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4
KCl+4Cl2↑+4H2O;
(3)甲的相对分子质量最小,则为NO,一定条件下2L甲气体与0.5L氧气相混合,生成NO2,且剩余NO,且二者等量,被碱液吸收发生氧化还原反应为NO+NO2+2NOH=2NaNO2+H2O,
则该盐为NaNO2,故答案为:NaNO2;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,则①Al(s)+
O2(g)=
Al2O3(s)△H=-aKJ/mol,②C(s)+O2(g)=CO2(g)△H=-bKJ/mol,
由盖斯定律可知,则①×4-②×3可得4Al(s)+3CO2(g)=3C(s)+2Al2O3(s),其反应热△H=(-aKJ/mol)×4-(-bKJ/mol)×3=-(4a-3b)KJ/mol,
故答案为:-(4a-3b)KJ/mol;
(5)与D同主族且相邻的元素的非金属为S,则将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成可证明S和Cl的非金属性强弱,故答案为:将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成.
(1)同周期从左向右非金属性在增强,则非金属性为O>N>C,故答案为:O>N>C;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl,该反应为8HCl+KClO4
| ||
故答案为:8HCl+KClO4
| ||
(3)甲的相对分子质量最小,则为NO,一定条件下2L甲气体与0.5L氧气相混合,生成NO2,且剩余NO,且二者等量,被碱液吸收发生氧化还原反应为NO+NO2+2NOH=2NaNO2+H2O,
则该盐为NaNO2,故答案为:NaNO2;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,则①Al(s)+
| 3 |
| 4 |
| 1 |
| 2 |
由盖斯定律可知,则①×4-②×3可得4Al(s)+3CO2(g)=3C(s)+2Al2O3(s),其反应热△H=(-aKJ/mol)×4-(-bKJ/mol)×3=-(4a-3b)KJ/mol,
故答案为:-(4a-3b)KJ/mol;
(5)与D同主族且相邻的元素的非金属为S,则将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成可证明S和Cl的非金属性强弱,故答案为:将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成.
点评:本题考查位置、结构、性质的应用,明确元素的位置判断出元素是解答本题的关键,并熟悉非金属性的比较方法、氧化还原反应、盖斯定律计算反应热等高考常考考点即可解答,题目难度中等,(3)为解答的难点.

练习册系列答案
相关题目
短周期主族元素A、B、C、D的原子序数依次增大.A、C原子序数相差8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A、原子半径:A<D<C<B | B、B、C、D分别与A形成的化合物一定含有相同的化学键 | C、最高价氧化物对应水化物的酸性:D<C | D、常温下,单质B能大量溶于浓硝酸中 |
短周期主族元素A、B、C的原子序数依次递增,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,它们原子的最外层电子数之和为10,则下列叙述正确的是( )
| A、原于半径A<B<C | B、A的气态氢化物稳定性大于C的气态氢化物稳定性 | C、A、C两元素最高价氧化物均可与水化合得到对应的酸 | D、高温时,A单质可以从C的氧化物中置换得到C单质 |
短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断中正确的是( )
| A、原子半径由小到大的顺序:r(C)<r(D)<r(E) | B、元素D、E分别与A形成的化合物的热稳定性:E>D | C、元素D的最高价氧化物对应水化物的酸性比E的强 | D、元素B分别与A、C形成的化合物中化学键的类型完全相同 |
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2