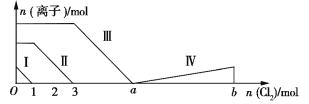
题目内容
【题目】下列解释相关的离子方程式错误的是
A. H2S溶于水:H2S+H2O![]() HS-+H3O+
HS-+H3O+
B. 向Na2S2O3溶液中加入稀硫酸:S2O3-+2H+=S↓+SO2↑+H2O
C. NH4Cl溶液呈酸性:NH4++H2O=NH3·H2O+H+
D. K2Cr2O7溶于水:Cr2O7-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
【答案】C
【解析】A. H2S是二元弱酸,溶于水的电离方程式为:H2S+H2O![]() HS-+H3O+,A正确;B. 向Na2S2O3溶液中加入稀硫酸发生氧化还原反应生成硫酸钠、二氧化硫和水,方程式为:S2O3-+2H+=S↓+SO2↑+H2O,B正确;C. 铵根水解,NH4Cl溶液呈酸性,铵根的水解方程式为:NH4++H2O
HS-+H3O+,A正确;B. 向Na2S2O3溶液中加入稀硫酸发生氧化还原反应生成硫酸钠、二氧化硫和水,方程式为:S2O3-+2H+=S↓+SO2↑+H2O,B正确;C. 铵根水解,NH4Cl溶液呈酸性,铵根的水解方程式为:NH4++H2O![]() NH3·H2O+H+,C错误;D. K2Cr2O7溶于水存在平衡关系:Cr2O7-+H2O
NH3·H2O+H+,C错误;D. K2Cr2O7溶于水存在平衡关系:Cr2O7-+H2O![]() 2CrO42-+2H+,D正确,答案选C。
2CrO42-+2H+,D正确,答案选C。

 寒假学与练系列答案
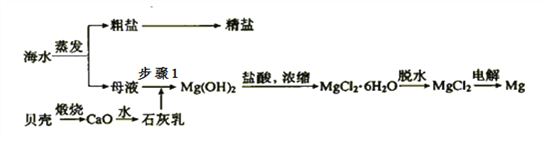
寒假学与练系列答案【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
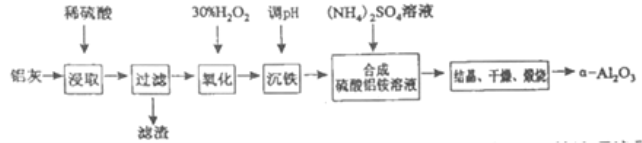
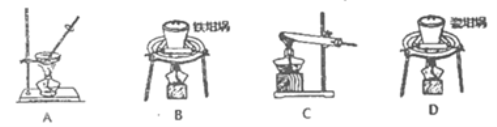
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号).
(2)流程中加入H2O2有气体产生,原因是___________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.己知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的____调节溶液pH(填字母),调节pH的范围为_____。
a.A12O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
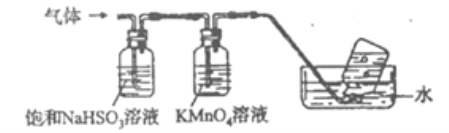
①集气瓶中收集到的气体是______(填化学式).
②装有KMnO4溶液洗气瓶的作用是________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________,写出硫酸铝铵加入足量该试剂的离子方程式_________________。