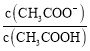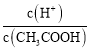题目内容
【题目】烟气脱硫后的物质可以再生、再利用。
(1)一种干法脱硫技术以CuO为吸收荆,并用CH4再生CuO,原理如下:
2CuO(s)+2SO2(g)+O2(g)=2CuSO4(s) ΔH1=akJ·mol-1
2CuSO4(s)+CH4(g)=2Cu(s)+2SO2(g)+CO2(g)+2H2O(l) ΔH2=bkJ·mol-1
2Cu(s)+O2(g)=2CuO(s) ΔH3=ckJ·mol-1
反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=___kJ·mol-1(用含a、b、c的代数式表示)。
(2)钠碱法脱硫后的吸收液中主要成分为NaHSO3、Na2SO3。用三室阴阳膜组合膜电解吸收液可再生得到Na2SO3,原理如图1所示。
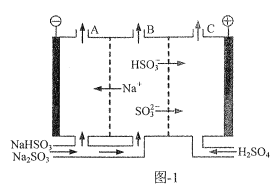
①写出电解时HSO3-在阳极发生反应的电极反应式:___。
②电解时采用吸收液低流速通过阴极的原因为___。
③如将阴离子交换膜电换成阳离子交换膜,则出口B溶液中的溶质主要是(填化学式)___。
(3)循环流化床烟气脱硫灰的主要成分有CaCO3、CaSO3·0.5H2O、CaSO3、CaSO4。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如图所示。
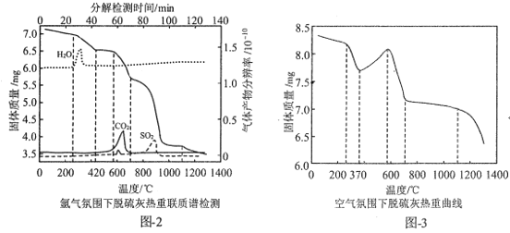
①图2中,1100℃时,残留固体主要成分为___;在600-630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少最的FeSO4分解导致的,写出该分解反应的化学方程式:___。
②对比图2与图3知,图3中370—42℃曲线上升的原因为___。
【答案】(a+b+c) ![]() -2e—+H2O===
-2e—+H2O===![]() +3H+ 使吸收液在阴极区充分反应,提高Na2SO3的再生率 NaHSO3和H2SO3 CaSO3、CaO 2FeSO4
+3H+ 使吸收液在阴极区充分反应,提高Na2SO3的再生率 NaHSO3和H2SO3 CaSO3、CaO 2FeSO4![]() Fe2O3+SO2↑+SO3↑ CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量
Fe2O3+SO2↑+SO3↑ CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量
【解析】
(1)根据盖斯定律可得,反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=ΔH1 +ΔH2+ ΔH3 =(a+b+c),故答案为(a+b+c);
(2)①电解时HSO3-在阳极失去电子,生成![]() ,发生反应的电极反应式为:
,发生反应的电极反应式为:![]() -2e—+H2O===
-2e—+H2O===![]() +3H+,故答案为:
+3H+,故答案为:![]() -2e—+H2O===
-2e—+H2O===![]() +3H+;
+3H+;
②电解时采用吸收液低流速通过阴极可以使吸收液在阴极区充分反应,提高Na2SO3的再生率,故答案为:使吸收液在阴极区充分反应,提高Na2SO3的再生率
③阴离子交换膜电换成阳离子交换膜,则H+和Na+与![]() 结合,所以出口B溶液中的溶质主要是NaHSO3和H2SO3,故答案为:NaHSO3和H2SO3;
结合,所以出口B溶液中的溶质主要是NaHSO3和H2SO3,故答案为:NaHSO3和H2SO3;
(3)①1100℃时,残留固体主要成分为CaSO3、CaO,根据图像分析可得,FeSO4分解生成Fe2O3、SO2和SO3气体,反应式为2FeSO4![]() Fe2O3+SO2↑+SO3↑,故答案为:CaSO3、CaO;2FeSO4
Fe2O3+SO2↑+SO3↑,故答案为:CaSO3、CaO;2FeSO4![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;
②因为CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量,所以370—42℃曲线上升,故答案为:CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量。