题目内容
3.下列各组表示式的意义相同的是( )| A. | -NO2,NO2 | B. | HCOOCH3,CH3OCHO | C. | HCOO-,-COOH | D. | C2H5OH,CH3OCH3 |
分析 A.-NO2 表示官能团,NO2表示物质;
B.HCOOCH3,CH3OCHO都表示甲酸甲酯;
C.HCOO-表示离子,-COOH表示官能团;
D.两种物质含有的官能团不同,一个是醇羟基,一个是醚基.
解答 解:A.-NO2 表示硝基,NO2表示二氧化氮,所以表示微粒不同,故A错误;
B.HCOOCH3是甲酸甲酯的结构简式,-CHO表示醛基,CH3OCHO也是甲酸甲酯的结构简式,所以表示相同微粒,故B正确;
C.HCOO-表示甲酸根离子,-COOH表示羧酸,所以表示不同微粒,故C错误;
D.CH3CH2OH是乙醇,CH3OCH3是甲醚,所以表示不同微粒,故D错误;
故选B.
点评 本题考查化学用语,明确物质含有的官能团是解本题关键,题目难度不大.

练习册系列答案
相关题目
11.下列关于电解质溶液中离子关系的说法或离子方程式书写正确的是( )
| A. | 用铜作电极电解NaCl溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) | |
| C. | 磷酸一氢钠溶液水解:HPO42-+H2O?PO42-+H3O+ | |
| D. | 常温下,由水电离产生的c(H+)=10-12mol•L-1的溶液,NH4+、SO42-、HCO3-、Cl-能大量共存 |
18.下列有机物属于芳香族化合物的是( )
| A. | 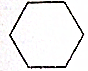 | B. |  | ||
| C. | 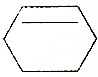 | D. |  |
8.下列叙述正确的是( )
| A. | 钾的原子质量就是钾的相对原子质量 | |
| B. | 一个硫原子的实际质量约等于$\frac{32}{(6.02×1{0}^{23})}$g | |
| C. | 水的相对分子质量为18g | |
| D. | 17g OH-中所含电子数为9NA |
4.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁能源 | |
| C. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化的过程 | |
| D. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
1.下列有关晶体的叙述正确的是( )
| A. | 离子晶体中每个离子周围均吸引着6个带相反电荷的离子 | |
| B. | 在晶体中,若有阳离子一定存在阴离子 | |
| C. | 分子晶体中一定不含有离子键,但一定存在共价键 | |
| D. | 原子晶体中的各相邻原子都以共价键结合 |
 和
和 ⑧CH3CH2CH2CH3 和CH3CH2CH(CH3)2
⑧CH3CH2CH2CH3 和CH3CH2CH(CH3)2