题目内容
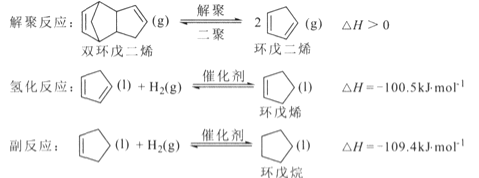
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
回答下列问题:
(l)反应![]() 的△H= _________ kJ/mol 。
的△H= _________ kJ/mol 。
(2)解聚反应在刚性容器中进行。
①其他条件不变,有利于提高双环戊二烯平衡转化率的条件是 ____ (填标号).
A.升高温度 B.降低温度 C.增大压强 D.减小压强
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为l00kPa的双环戊二烯和水蒸气,达到平衡后总压为160kPa,双环戊二烯的转化率为8 0%,则 pH2O=___kpa,平衡常数Kp=______kPa (Kp为以分压表示的平衡常数)
(3) 一定条件下,将环戊二烯溶于有机溶剂中进行氢化反应,反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如下图所示。

①将环戊二烯溶于有机溶剂中可减少二聚反应的发生,原因是____,
②最佳的反应时间为__h。活化能较大的是__(填“氢化反应”或“副反应”)。
(4)已知氢化反应平衡常数为1.6 × 1012,副反应的平衡常数为2.0×10l2。在恒温恒容下,环戊二烯与氢气按物质的量之比为1:1进行反应,则环戊二烯的含量随时间变化趋势是____(不考虑环戊二烯的二聚反应)。
【答案】-209.9 AD 25 960 降低环戊二烯浓度,减小二聚速率;稀释有利于平衡向解聚方向移动 4 副反应 先变小后变大(最后不变)
【解析】
(1)已知![]() ,
,
![]() ,根据盖斯定律,由氢化反应+副反应得反应
,根据盖斯定律,由氢化反应+副反应得反应![]() △H=-100.5kJ/mol-109.4kJ/mol=-209.9kJ/mol;
△H=-100.5kJ/mol-109.4kJ/mol=-209.9kJ/mol;
(2)①提高双环戊二烯平衡转化率则平衡正向移动;
A.升高温度,平衡向吸热反应的正反应方向移动,选项A符合;
B.降低温度,平衡向放热反应的逆反应方向移动,选项B不符合;
C.增大压强,平衡向气体体积缩小的逆反应方向移动,选项C不符合;
D.减小压强,平衡向气体体积增大的正反应方向移动,选项D符合;
答案选AD;
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为l00kPa的双环戊二烯和水蒸气,达到平衡后总压为160kPa,则增压60kPa,双环戊二烯的转化率为8 0%,则反应前双环戊二烯的分压为![]() ,则 pH2O=l00kPa-75kPa=25kPa,平衡时双环戊二烯、环戊二烯的平衡分压分别为15kPa、120kPa,平衡常数Kp=
,则 pH2O=l00kPa-75kPa=25kPa,平衡时双环戊二烯、环戊二烯的平衡分压分别为15kPa、120kPa,平衡常数Kp=![]() =960kPa;
=960kPa;
(3)①将环戊二烯溶于有机溶剂中可减少二聚反应的发生,原因是降低环戊二烯浓度,减小二聚速率;稀释有利于平衡向解聚方向移动;
②根据图中信息可知,4h时环戊烯的产率最大,故最佳的反应时间为4h。根据各反应的焓变以及环戊烯和环戊烷产率随时间的变化曲线可知,活化能较大的是副反应;
(4)已知氢化反应平衡常数为1.6 ×1012,副反应的平衡常数为2.0×1012。在恒温恒容下,环戊二烯与氢气按物质的量之比为1:1进行反应,开始一段时间,氢化反应的活化能较小,氢化反应比副反应快,环戊二烯的含量随时间的推移变小;一段时间后,由于副反应的平衡常数大于氢化反应的平衡常数,副反应进行的程度大、放热多,使氢化反应逆向进行,环戊二烯的含量随时间推移又变大,直至最后不变。

【题目】T K时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应 ![]() ,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是
,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
A. 反应在前2s的平均速率![]() mol·L-1·s-1
mol·L-1·s-1
B. 保持其他条件不变,升高温度,若新平衡时c(C12)=0.038mol·L-1,则反应的△H<0
C. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
D. T K时该反应的化学平衡常数为![]()