题目内容
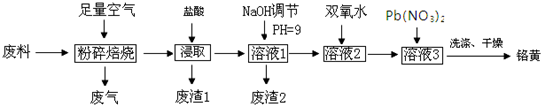
1.实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图1:
(1)向含碘废液中加人稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+;该操作将I2还原为I-的目的是使CCl4中的碘进入水层.
(2)操作X的名称为分液.
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图2所示).实验控制在较低温度下进行的原因是使氯气在溶液中有较大的溶解度,防止I2升华或进一步被氧化;锥形瓶里发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)某含碘废水(pH约为8)中一定存在I2和 I-,可能存在IO3-.请补充完整检验含碘废水中是否含有IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;从水层取少量溶液,加入1-2 mL淀粉溶液,再加入盐酸酸化,若溶液变蓝,说明废水中含有IO3-,若溶液不变蓝,说明废水中不含有IO3-.(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、KI溶液)
分析 碘废液加亚硫酸钠溶液,把单质碘还原为I-,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化I-得到I2,富集,最后得到较纯的I2;
(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘微溶于水,而碘离子易溶于水;
(2)分离互不相溶的液体采用分液的方法分离;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色.
解答 解:碘废液加亚硫酸钠溶液,把单质碘还原为I-,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化I-得到I2,富集,最后得到较纯的I2;
(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子,
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使CCl4中的碘进入水层;
(2)四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法,故答案为:分液;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,锥形瓶里发生反应是氯气和碱反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:使氯气在溶液中有较大的溶解度或防止碘升华或防止碘进一步被氧化;Cl2+2OH-=Cl-+ClO-+H2O;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-;
故答案为:从水层取少量溶液,加入1-2 mL淀粉溶液,再加入盐酸酸化,若溶液变蓝,说明废水中含有IO3-,若溶液不变蓝,说明废水中不含有IO3.
点评 本题主要考查了工业制备氯气、盐类水解、氧化还原反应、离子的检验、物质的分离和提纯等知识点,中等难度,元素的推断是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | Cu电极上发生氧化反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(K+)增大 | D. | 片刻后可观察到滤纸a点变红色 |
| 序号 | 操作及现象 | 结论 |
| A | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| B | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度减小 |
| C | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| D | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 5种 | B. | 8种 | C. | 11种 | D. | 14种 |
| A. | 最外层电子数为次外层电子数一半的短周期主族元素只有Li、Si两种元素 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素 | |
| C. | 同周期第ⅡA族与第ⅢA族元素的原子序数相差1或11或25 | |
| D. | 若主族元素的族序数为a,周期数为b,当$\frac{a}{b}$<1,该元素为非金属元素 |
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F第一电离能依次增大 | |
| D. | Na、K、Rb电负性逐渐减小 |