题目内容
16.同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序为X<Y<Z,则下列判断中正确的是( )| A. | 非金属性X<Y<Z | |
| B. | 气态氢化物的热稳定性按X、Y、Z顺序减弱 | |
| C. | X、Y、Z的最高价氧化物对应水化物酸性由弱到强 | |
| D. | X、Y、Z最外层电子数依次减少 |
分析 同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则其原子序数大小顺序是X>Y>Z,
A.同一周期元素,元素的非金属性随着原子序数增大而增强;
B.元素的非金属性越强,其气态氢化物的稳定性越强;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.同一周期元素,原子最外层电子数随着原子序数增大而增多.
解答 解:同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则其原子序数大小顺序是X>Y>Z,
A.同一周期元素,元素的非金属性随着原子序数增大而增强,所以元素的非金属性:X>Y>Z,故A错误;
B.元素的非金属性越强,其气态氢化物的稳定性越强,元素的非金属性X>Y>Z,则气态氢化物的稳定性:X>Y>Z,故B正确;
C.元素的非金属性X>Y>Z,所以X、Y、Z的最高价氧化物水化物的酸性由强到弱,故C错误;
D.同一周期元素,原子最外层电子数随着原子序数增大而增多,所以X、Y、Z原子的最外层电子数依次减少,故D正确;
故选BD.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,明确同一周期中非金属性、非金属的非金属性与氢化物的稳定性及最高价氧化物的水化物关系即可解答,熟练掌握同一周期、同一主族元素递变规律.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
6.若将pH=2的酸溶液和pH=12的NaOH溶液等体积混和.混和液中的pH值为( )
| A. | 等于7 | B. | 大于等于7 | C. | 小于等于7 | D. | 无法判断 |
7.在水溶液中能够大量共存的离子组是( )
| A. | Na+,Ca2+,HCO3-,OH- | B. | K+,NH4+,S2-,OH- | ||
| C. | Mg2+,K+,HSO3-,H+ | D. | K+,Na+,NO3-,CO32- |
4.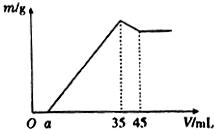 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )| A. | 3.50mol/L | B. | 1.75mol/L | C. | 0.85mol/L | D. | 无法计算 |
11.下列各组微粒中,核外电子总数相等的是( )
| A. | O3和CO2 | B. | OH-和Al3+ | C. | NO和CO | D. | Cl-和Ne |
2.200mL 0.3mol•L-1的K2SO4溶液和100mL 0.2mol•L-1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO${\;}_{4}^{2-}$的物质的量浓度为( )
| A. | 0.3 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.45 mol•L-1 | D. | 0.5 mol•L-1 |
3.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物  在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(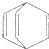 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |
