题目内容
11.下列各组微粒中,核外电子总数相等的是( )| A. | O3和CO2 | B. | OH-和Al3+ | C. | NO和CO | D. | Cl-和Ne |
分析 在原子中,核内质子数等于核外电子数,分子是由原子构成的,分子的电子总数就等于构成分子的各原子的电子数之和;阳离子的核外电子数等于核内质子数-电荷数,阴离子中的核外电子数为质子数之和加上微粒的电荷数,据此分析解答.
解答 解:A.O原子的有8个质子,8个电子,O3有核外电子总数为24,碳原子有6个电子,氧原子有8个电子,CO2中核外电子总数是22,核外电子总数不相等,故A错误;
B.OH-的核外电子总数为10,Al3+的质子数为13,核外电子总数为10,二者核外电子总数相等,故B正确;
C.NO的核外电子总数为15,CO的核外电子总数为14,二者的核外电子总数不相等,故C错误;
D.Cl-的核电荷数为17,核外电子总数为18,Ne的核外电子总数=核电荷数=10,二者的核外电子总数不相等,故D错误;
故选B.
点评 本题主要考查了分子、离子中电子数的计算,题目难度中等,对于常见的微粒,根据微粒的构成情况确定质子数和电子数是解答的关键.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
1.下列说法中不正确的是( )
| A. | 酸雨会腐蚀大理石雕像 | |
| B. | 超量使用着色剂对人体是无害的 | |
| C. | 大气污染物既危害人体健康,又影响动植物的生长 | |
| D. | 食物中的维生素和微量元素可以提供人体的正常需要 |
2.下列各反应达到平衡时,加压或降温都能使平衡向逆反应方向移动的是( )
| A. | 2NO2(g)?N2O4(g)(正反应放热) | B. | N2 (g)+O2(g)?2NO(g) (正反应吸热) | ||
| C. | 2SO2(g)+O2(g)?2SO3(g)(正反应放热) | D. | C(s)+H2O(g)?CO(g)+H2(g) (正反应吸热) |
16.同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序为X<Y<Z,则下列判断中正确的是( )
| A. | 非金属性X<Y<Z | |
| B. | 气态氢化物的热稳定性按X、Y、Z顺序减弱 | |
| C. | X、Y、Z的最高价氧化物对应水化物酸性由弱到强 | |
| D. | X、Y、Z最外层电子数依次减少 |
3.常温下,下面物质可用铁制或铝制容器盛放的是( )
| A. | 浓盐酸 | B. | 硫酸铜溶液 | C. | 稀硫酸 | D. | 浓硫酸 |
17.在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g),在2L的密闭容器中把4mol A和2mol B混合,2min后反应达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol•L-1•min-1.则下列说法不正确的是( )
| A. | z=4 | B. | B的转化率是40% | ||
| C. | A的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来的1.2倍 |
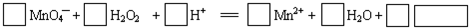
 一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
 .
.