题目内容
6.若将pH=2的酸溶液和pH=12的NaOH溶液等体积混和.混和液中的pH值为( )| A. | 等于7 | B. | 大于等于7 | C. | 小于等于7 | D. | 无法判断 |
分析 pH=2的某酸溶液和pH=12的氢氧化钠溶液中,酸中的c(H+)=0.01mol/L,氢氧化钠溶液中c(OH-)=0.01mol/L,酸的强弱不同,反应后溶液的酸碱性不同.
解答 解:酸中的c(H+)=0.01mol/L,氢氧化钠溶液中c(OH-)=0.01mol/L.
若酸为强酸,c(H+)=0.01mol/L为酸中的全部氢离子,则等体积混合,恰好反应生成强酸强碱盐,溶液呈中性,pH等于7;
若酸为弱酸,c(H+)=0.01mol/L只是酸中电离出的氢离子,还有大量的弱酸分子未电离,故和氢氧化钠等体积混合时,反应后酸过量,溶液呈酸性,pH小于7;
故选C.
点评 本题考查pH的简单判断,注意根据酸、碱的强弱判断溶液的过量问题,以此判断溶液的酸碱性,难度不大.

练习册系列答案
相关题目
16.实验室要用固体氯化钠试剂准确配制500mL 0.2mol•L-1的NaCl溶液,下列哪种仪器一定用不到的是( )
| A. | 500 mL容量瓶 | B. | 胶头滴管 | C. | 试管 | D. | 托盘天平 |
17.有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2;②KCl;③NaOH;④CuSO4;⑤Na2SO4.如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开,则在下列的鉴别顺序中,最合理的是( )
| A. | ④③①⑤② | B. | ①④③⑤② | C. | ①⑤③④② | D. | ③④①⑤② |
14.下列叙述错误的是( )
| A. | 在热化学方程式中,物质化学式前面的化学计量数可以为整数也可以为简单分数 | |
| B. | 同一化学反应,热化学方程式中物质的化学计量数不同,反应的△H也不同 | |
| C. | 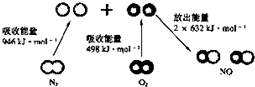 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 N2(g)与O2(g)反应生成NO(g)过程中的能量变化如图所示,若加入催化剂,化学反应速率改变,△H也改变 | |
| D. | 化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 |
1.下列说法中不正确的是( )
| A. | 酸雨会腐蚀大理石雕像 | |
| B. | 超量使用着色剂对人体是无害的 | |
| C. | 大气污染物既危害人体健康,又影响动植物的生长 | |
| D. | 食物中的维生素和微量元素可以提供人体的正常需要 |
11.下列各物质既能与强酸反应,又能与强碱反应的是( )
①Na2SO4;②AlCl3;③Al(OH)3;④Al2O3;⑤NaHCO3;⑥(NH4)2CO3.
①Na2SO4;②AlCl3;③Al(OH)3;④Al2O3;⑤NaHCO3;⑥(NH4)2CO3.
| A. | ①②③④⑤⑥ | B. | ①②④⑤⑥ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
18.下列说法正确的是( )
| A. | 增大压强,活化分子百分数增大,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率可能增大 | |
| C. | 加入反应物,使活化分子百分数增大,化学反应速率增大 | |
| D. | 使用正催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
15.下列同组中的两种物质,属于官能团异构的是( )
| A. | CH3CH2CH2OH和 CH3CH(OH)CH3 | |
| B. | CH3CH(CH3)2和CH3CH2CH2CH3 | |
| C. | CH3CH2OH和CH3OCH3 | |
| D. | CH2=CHCH2CH2CH3和CH3CH2CH=CHCH3 |
16.同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序为X<Y<Z,则下列判断中正确的是( )
| A. | 非金属性X<Y<Z | |
| B. | 气态氢化物的热稳定性按X、Y、Z顺序减弱 | |
| C. | X、Y、Z的最高价氧化物对应水化物酸性由弱到强 | |
| D. | X、Y、Z最外层电子数依次减少 |