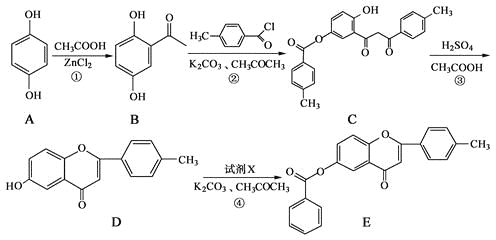
��Ŀ����
����Ŀ��(1)д�����и������ķ���ʽ��
������A��ͬ��ͬѹ���������ܶ���H2��43��__________��
������B�ķ����к���200����ԭ��____________��
��1L����C��������ȫȼ��ʱ������ͬ��ͬѹ��15L��ˮ����____________��
��0.1mol����D��ȫȼ�գ����ı�״���µ�O2 11.2L________________��
(2)��ϩ��һ����Ҫ�Ļ���ԭ�ϣ���������ת����ϵ�ش�
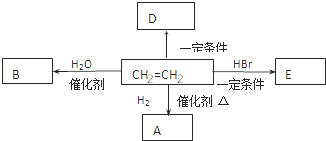
����ϩ�����й����ŵ�������_________ ��
��E�ķ���ʽ��___________��
����ϩת����A�Ļ�ѧ����ʽ��____________________ ����Ӧ������_________ ��
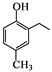
����֪D��һ�ֳ����ĸ߷��Ӳ��ϣ�д�����Ľṹ��ʽ__________________ ��
���𰸡�C6H14 C99H200 C14H30 C3H8 ̼̼˫�� C2H5Br CH2=CH2+H2![]() CH3-CH3 �ӳɷ�Ӧ
CH3-CH3 �ӳɷ�Ӧ ![]()
��������
(1)��ͬ��ͬѹ�£��ܶ�����Է������������ȣ���������ͨʽ�������ʽ��
�ڸ�������ͨʽ![]() ���㣻
���㣻
������ȼ��ͨʽ��������C�ķ���ʽ��
������ȼ��ͨʽ��������D�ķ���ʽ��
(2)��ϩ����̼̼˫������ˮ�����ӳɷ�Ӧ�����Ҵ������廯�ⷢ���ӳɷ�Ӧ���������顢�����������ӳɷ�Ӧ�������顢�����Ӿ۷�Ӧ���ɸ߷��ӻ��������ϩ��
(1)��ͬ��ͬѹ�£��ܶ�����Է������������ȣ�����A����Է���������86������ͨʽ��![]() ��12n+2n+2=86��n=6������ʽ��C6H14��
��12n+2n+2=86��n=6������ʽ��C6H14��
������ͨʽ![]() �������к���200����ԭ�ӣ���2n+2=200��n=99������ʽ��C99H200��
�������к���200����ԭ�ӣ���2n+2=200��n=99������ʽ��C99H200��
��![]() ��1L����C��������ȫȼ��ʱ������ͬ��ͬѹ��15L��ˮ��������n+1=15��n=14������C�ķ���ʽC14H30��
��1L����C��������ȫȼ��ʱ������ͬ��ͬѹ��15L��ˮ��������n+1=15��n=14������C�ķ���ʽC14H30��
��![]() ��0.1mol����D��ȫȼ�գ����ı�״���µ�O2 11.2L����
��0.1mol����D��ȫȼ�գ����ı�״���µ�O2 11.2L����![]() =5��n=3������D�ķ���ʽC3H8��
=5��n=3������D�ķ���ʽC3H8��
(2) ����ϩ���ӵĽṹ��ʽ��CH2=CH2�����й����ŵ�������̼̼˫����
����ϩ���廯�ⷢ���ӳɷ�Ӧ���������飬E�ķ���ʽ��C2H5Br��
����ϩ�����������ӳɷ�Ӧ�������飬��ϩת��������Ļ�ѧ����ʽ��CH2=CH2+H2![]() CH3-CH3����Ӧ�����Ǽӳɷ�Ӧ��
CH3-CH3����Ӧ�����Ǽӳɷ�Ӧ��
����ϩ�����Ӿ۷�Ӧ���ɾ���ϩ������ϩ�Ľṹ��ʽ��![]() ��
��