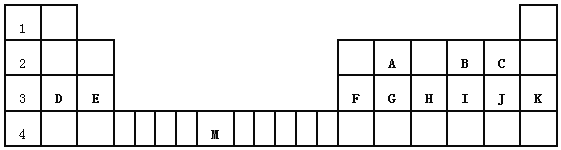
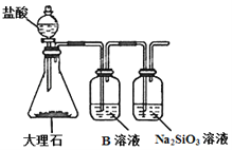
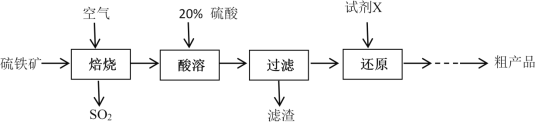
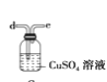
题目内容
【题目】将Mg—Cu合金11.2g完全溶解于硝酸中,反应产生的X气体,再向所得溶液中加入NaOH溶液,恰好完全反应时产生21.4g沉淀,根据题意推断X气体的成份可能是
A. 0.3molNO
B. 0.2molNO2和0.1molN2O4
C. 0.1molNO、0.2molNO2和0.05molN2O4
D. 0.1molNO、0.1molNO2和0.2molN2O4
【答案】C
【解析】
![]() ,得出:失去电子的物质的量等于得到OH-的物质的量,沉淀是氢氧化镁和氢氧化铜,其质量=m(合金)+m(OH-),故m(OH-)=21.4-11.2g=10.2g,因此合金失去电子的物质的量等于n(OH-)=10.2/17mol=0.6mol,根据上述关系式,合金失去电子给了硝酸,硝酸得到电子转变成X,然后根据得失电子数目守恒,确定X
,得出:失去电子的物质的量等于得到OH-的物质的量,沉淀是氢氧化镁和氢氧化铜,其质量=m(合金)+m(OH-),故m(OH-)=21.4-11.2g=10.2g,因此合金失去电子的物质的量等于n(OH-)=10.2/17mol=0.6mol,根据上述关系式,合金失去电子给了硝酸,硝酸得到电子转变成X,然后根据得失电子数目守恒,确定X
A、加入生成0.3molNO,需要电子0.3×(5—2)mol=0.9mol≠0.6mol,故错误;
B、0.2×(5-4)+0.1×2×(5-4)=0.4≠0.6mol,故错误;
C、0.1×(5-2)+0.2×(5-4)+0.05×2×(5-4)=0.6mol,故正确;
D、0.1×3+0.1×1+0.2×2=0.8mol≠0.6mol,故错误。

【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是_____________________________。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH >7,该溶液中离子浓度从大到小的排列为________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01 mol·L-1,则溶液中CO32-物质的量浓度应 ≥ ______________。