题目内容
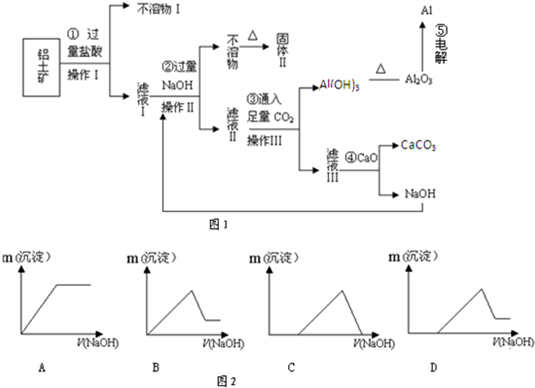
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
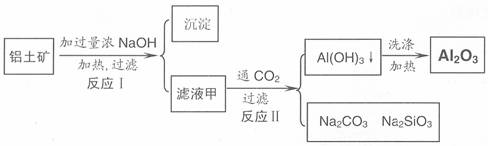
(1)滤液甲的主要成分是(写化学式)
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是
(填字母序号)
a.AlO2 或 [Al(OH)4]- b.OH c.SiO32
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为:
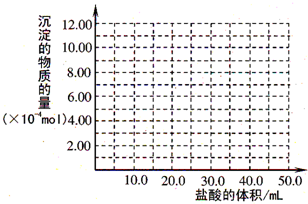
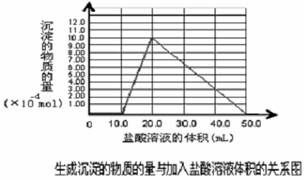
(5)取(4)电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为: 。
②请画出生成沉淀的物质的量与加入盐酸体积的关系图。
(1)NaOH、Na[Al(OH)4](或NaAlO2)、Na2SiO3
(2)CO2+2OH-==CO32-+2H2O
CO2+2[Al(OH)4]-==2Al(OH)3↓+CO32-+H2O
(3)b>a>c
(4)Al(OH)3 +OH-=[Al(OH)4]- 或Al(OH)3 +OH-=AlO2-+2H2O
(5)① H++OH-==H2O
[Al(OH)4]-+H+==Al(OH)3↓+H2O
Al(OH)3+3H+==Al3++3H2O
② 图像如下所表示。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案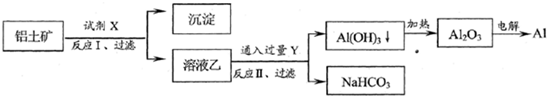
对上述流程中的判断正确的是( )
| A、试剂X为稀硫酸 | B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O→Al(OH)3↓+HCO3- | C、结合质子(H+)的能力由强到弱的顺序是:OH->AlO2->CO32- | D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |