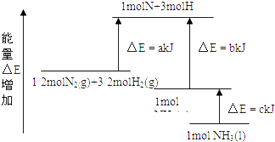
��Ŀ����
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
��֪��A��B��C��D����Ԫ�أ�ԭ��������������A�Ƕ�����Ԫ���н�������ǿ��Ԫ�أ�BԪ��3p�ܼ��������C���������ڵ縺������Ԫ�أ�D�ǵ�������δ�ɶԵ�������Ԫ�ء��Իش������й����⣺
��1��д��DԪ�ؼ۵��ӵĵ����Ų�ʽ��
��2��D���γɻ�����[D(H2O)6](NO3)3��
��[D(H2O)6](NO3)3�������ӵ����幹������NO3����ԭ�ӵĹ���ӻ�����Ϊ��
����[D(H2O)6]3+��D3+��H2O֮���γɵĻ�ѧ����Ϊ �� 1 mol [D(H2O)6] 3+�к��еĦҼ���mol��
��3����֪B��C����Ԫ���γɵĻ�����ͨ�������֡������ֻ�������(�ѧʽ)Ϊ�Ǽ��Է��ӡ���һ�����ʵĵ���ʽΪ��
��4����A��C��Ԫ���γɵĻ�������ɵľ����У����������Ӷ��������ͶԳƽṹ�����Ƕ����Կ�������Բ���˴ˡ����С�������ͼ��ʾΪA��C�γɻ�����ľ����ṹͼ�Լ�����������ͼ��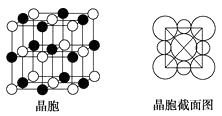
�����о���һ��A+�����C��������ЩCΧ�ɵ�ͼ�������������ܶ�Ϊ�� g��cm3 �� �����ӵ�������ֵ��NA��ʾ����A+�����Ӱ뾶Ϊcm(�ú�NA������ʽ�ӱ���)��
���𰸡�
��1��3d54s1
��2��ƽ�������Σ�sp2�ӻ�����λ����18
��3��PCl5��![]()
��4��6���������壻![]()
���������⣺A�Ƕ�������ԭ�Ӱ뾶����Ԫ�أ���AΪ��Ԫ�أ�BԪ��3p�ܼ��������ԭ��������A����BΪ��Ԫ��;D�ǵ�������δ�ɶԵ�������Ԫ�أ���D�ĵ����Ų�Ϊ[Ar]3d54s1��Ԫ��Ϊ��;Cֻ��λ�ڵ������ڣ������ڵ縺������Ԫ������Ԫ�ء�(1)DΪ��Ԫ�أ���۵����Ų�Ϊ3d54s1����2����NO3-����ԭ�ӵ�ԭ�ӵļ۵��Ӷ���Ϊ ![]() =3����Nԭ��Ϊsp2�ӻ��������Ӧ�����幹����ƽ�������Ρ�����[D(H2O)6]3+��Cr3+�пյ�ԭ�ӹ������H2O���ӵ���ԭ���й¶Ե��ӣ�H2O�еŶԵ������Cr3+�Ŀչ�����γ���λ����[D(H2O)6]3+��6����λ�����ǦҼ���ÿ��ˮ��������ԭ������ԭ���γɶ����Ҽ������1mol��[D(H2O)6]3+�к���18mol�ĦҼ�,��3��B��
=3����Nԭ��Ϊsp2�ӻ��������Ӧ�����幹����ƽ�������Ρ�����[D(H2O)6]3+��Cr3+�пյ�ԭ�ӹ������H2O���ӵ���ԭ���й¶Ե��ӣ�H2O�еŶԵ������Cr3+�Ŀչ�����γ���λ����[D(H2O)6]3+��6����λ�����ǦҼ���ÿ��ˮ��������ԭ������ԭ���γɶ����Ҽ������1mol��[D(H2O)6]3+�к���18mol�ĦҼ�,��3��B��
C�γɵ����ֳ���������ΪPCl5��PCl3 �� ����PCl5��������ԭ�ӵļ۵���ȫ������ɼ���û�й¶Ե��ӣ���ԭ������ԭ���γɶ�����ۼ����ռ乹��Ϊ����˫�Σ���ɷֲ��Գƣ�������������غϣ������ǷǼ��Է��ӡ�PCl3����ԭ����������������ԭ�ӹ��ã��γ��������ۼ�����һ�Թ¶Ե��ӣ��Ǽ��Է��ӣ������ʽΪ: ![]() ��(4)A��C��Ԫ���γɵĻ�����ΪNaCl���Ӿ����ṹ��������뾶С����Na+ �� ����
��(4)A��C��Ԫ���γɵĻ�����ΪNaCl���Ӿ����ṹ��������뾶С����Na+ �� ����
�뾶�����Cl- �� ��ѡ�����������ĵ�Na+��Ϊ�о�����������Na+�����Cl-�ֱ�λ��6��������ģ���6��Cl-Χ��һ���������塣�����е�1��Na+λ�����ģ�12��Na+�ֱ�λ��12������е㣬���ݾ�̯������øþ���ӵ�е�Na+��Ϊ��1+12�� ![]() =4��������6�������������1��Cl- �� �˸��������һ��Cl- �� ͬ������øþ���ӵ�е�Cl-��Ϊ:6��
=4��������6�������������1��Cl- �� �˸��������һ��Cl- �� ͬ������øþ���ӵ�е�Cl-��Ϊ:6�� ![]() +8��
+8�� ![]() =4���辧���ı߳�Ϊa�������ܶȹ�ʽ�ɵã���-a3=4��
=4���辧���ı߳�Ϊa�������ܶȹ�ʽ�ɵã���-a3=4�� ![]() �����ε�a=
�����ε�a= ![]() ,�Ӿ�������ͼ��:a-2r++2r-��r+��r-�ֱ��ʾNa+��Cl-�İ뾶����4r-=
,�Ӿ�������ͼ��:a-2r++2r-��r+��r-�ֱ��ʾNa+��Cl-�İ뾶����4r-= ![]() ��4r-Ϊ����Խ��߳��ȣ�����r+=
��4r-Ϊ����Խ��߳��ȣ�����r+= ![]() ���˼�Ϊ�����Na+�뾶��
���˼�Ϊ�����Na+�뾶��